
| 品种:威尔士柯基犬 | |
| 年龄:9岁 | |
| 性别:未知 | |
| 诊断:颅内组织细胞肉瘤 | |
01 主诉及病史
因四肢瘫痪、排尿困难和攻击性增强持续2个月就诊。
02 检查
体重11.5千克。第1天的神经系统检查显示,右前肢和后肢姿势反应减弱,右眼视力受损。碱性磷酸酶(919 IU/l [47-254])和脂肪酶(221 IU/l [10-160])较高。胸部放射线检查和腹部超声均无异常。
第5天进行了头部MRI检查。左侧额叶有一个实性肿块,大小为32.4×29.9×27.7 mm,呈均匀对比增强,对比增强T1加权成像(T1WI)显示脑中线向右偏移(下图)。对比增强T1WI图像显示肿瘤边缘与脑膜连续。在T2加权成像(T2WI)和FLAIR图像上,肿瘤周围脑实质的高信号强度结果显示存在水肿和/或炎症。没有收集脑脊液,因为怀疑颅内压增高。
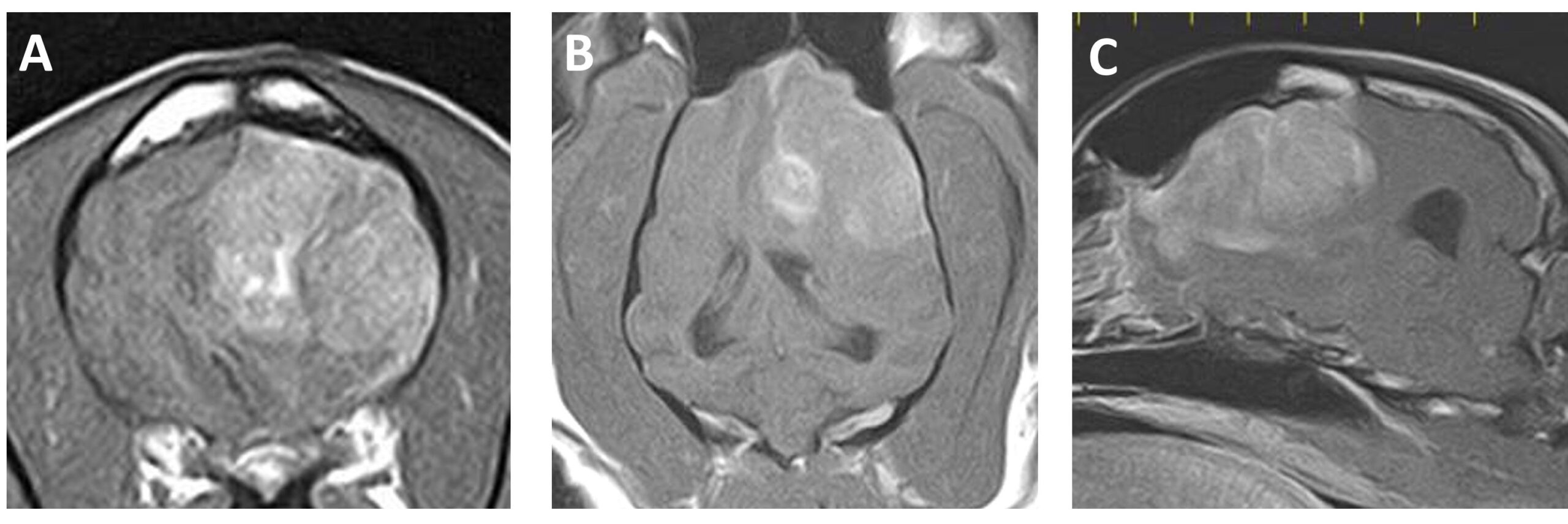
MRI结果显示可能是脑膜瘤或组织细胞肉瘤,主人要求进行手术,并使用抗癌药物进行药物治疗。由于费用问题,主人拒绝了放疗。口服泼尼松龙(每天一次,1 mg/kg),直到手术为止。
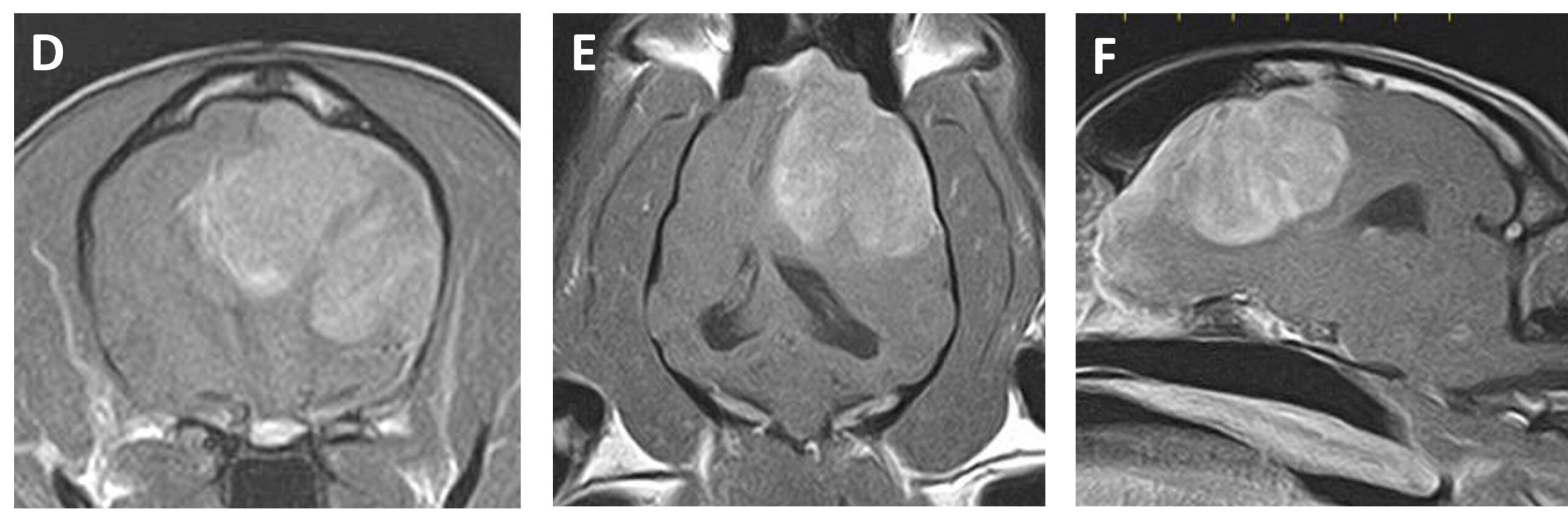
第26天,再次进行MRI检查,发现病灶已增大到34.7×29.9×34.9 mm(下图)。
第27天,进行了经额开颅活检。进行了马罗吡坦(1 mg/kg)、芬太尼(3μg/kg)和利多卡因(2 mg/kg)的静脉注射预处理。用丙泊酚诱导全身麻醉,然后在丙泊酚基础上进行全静脉麻醉,同时恒速输注芬太尼(10-15μg/kg/hr)和美托咪定(1-3μg/kg/h)以维持麻醉。术中静脉注射琥珀酸甲泼尼龙钠(10 mg/kg)和果糖补充甘油30分钟,以分别确保神经保护和降低颅内压。
虽然在开颅手术中可以看到肿瘤,但肿瘤很容易出血,因此只采集到了少量组织。术后进行了MRI,但未观察到肿瘤大小有明显变化(下图)。
手术后,患者从麻醉中恢复,并在拔管1小时后顺利出院。术后治疗包括晶体液输注、泼尼松龙(2 mg/kg,每天一次)和唑尼沙胺(3 mg/kg,每天两次)。
活检组织的组织病理学结果显示,组织中出现了密集的片状轻度非典型肿瘤性圆形细胞,类似于单核细胞/组织细胞/巨噬细胞。肿瘤细胞有丰富、苍白的花边胞质,圆形至卵圆形低色素核,中度异核,一个或两个核小体。在2.37平方毫米的区域内,有丝分裂计数为2。一些肿瘤细胞核较少或较大。罕见的肿瘤细胞吞噬脂褐素样的淡黄色均质物质。肿瘤细胞的背景含有少量纤维血管组织和少量淋巴细胞、浆细胞和中性粒细胞。Ziel-Neelsen染色法未在肿瘤细胞的细胞质中检测到任何酸性细菌。肿瘤细胞的免疫组化显示,Iba-1抗体(小胶质细胞的标记物)呈膜和胞浆阳性反应,波形蛋白抗体(间质细胞的标记物)呈胞浆阳性反应。根据组织形态学和免疫组化结果,最终诊断为脑组织细胞肉瘤(下图)。
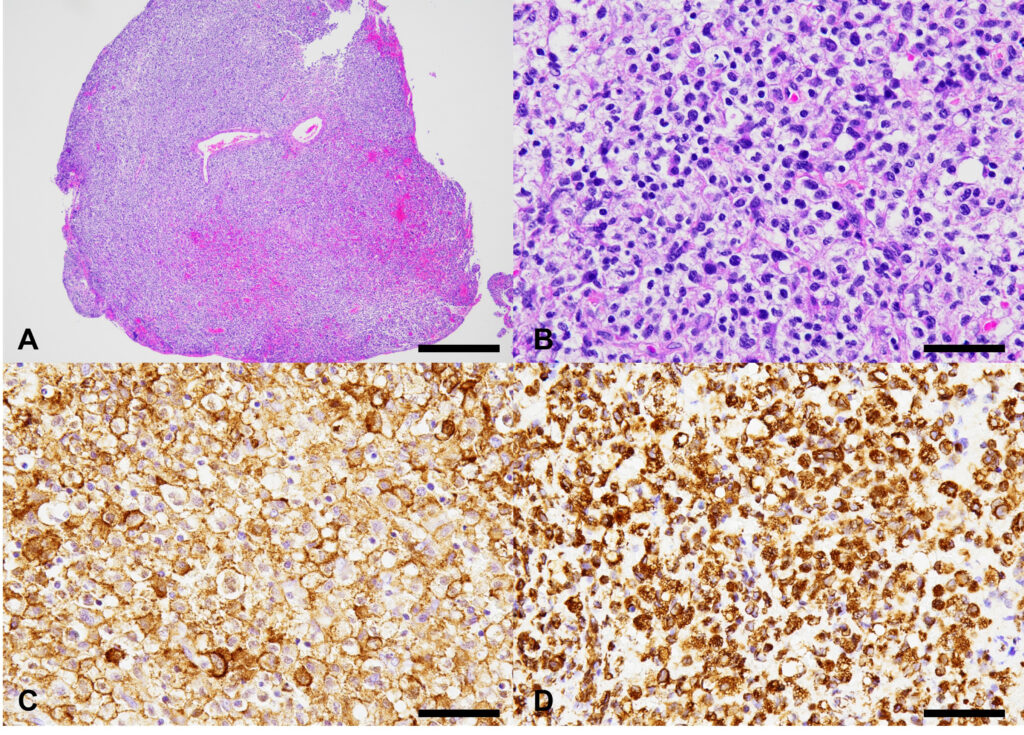
↑ 脑肿瘤的组织学和免疫组化特征。A:病变由致密的片状肿瘤性圆形细胞组成。B:肿瘤细胞有丰富、苍白的花边细胞质,圆形至卵圆形低色素核,中度异核,1或2个突出核仁。C:肿瘤细胞对Iba-1抗体呈膜性和胞浆性阳性反应。D:肿瘤细胞对波形蛋白抗体呈细胞质阳性反应。
03 治疗
第37天,全身状况好转而出院,并继续服用泼尼松龙和唑尼沙胺。
第43天,因功能紊乱性厌食数天后返回医院。患者嗜睡且处于侧卧位,由于颅内压增高,为其静脉注射了甘油。同一天,静脉注射了25 mg/m2的尼莫司汀,另外还处方了70%异山梨醇(每次10 mL,每天两次)。
第一次尼莫司汀注射一周后,患者能够站立,但有轻微瘫痪,总体状况也有所改善。除了严重的中性粒细胞减少(160个/µl)外,没有观察到其他不良反应。
第62天,出现了胰腺炎,住院8天后好转。出院后,泼尼松龙剂量降至0.5 mg/kg,并继续使用。
第82天,接受了第二次尼莫司汀(20 mg/m2)治疗。
04 预后
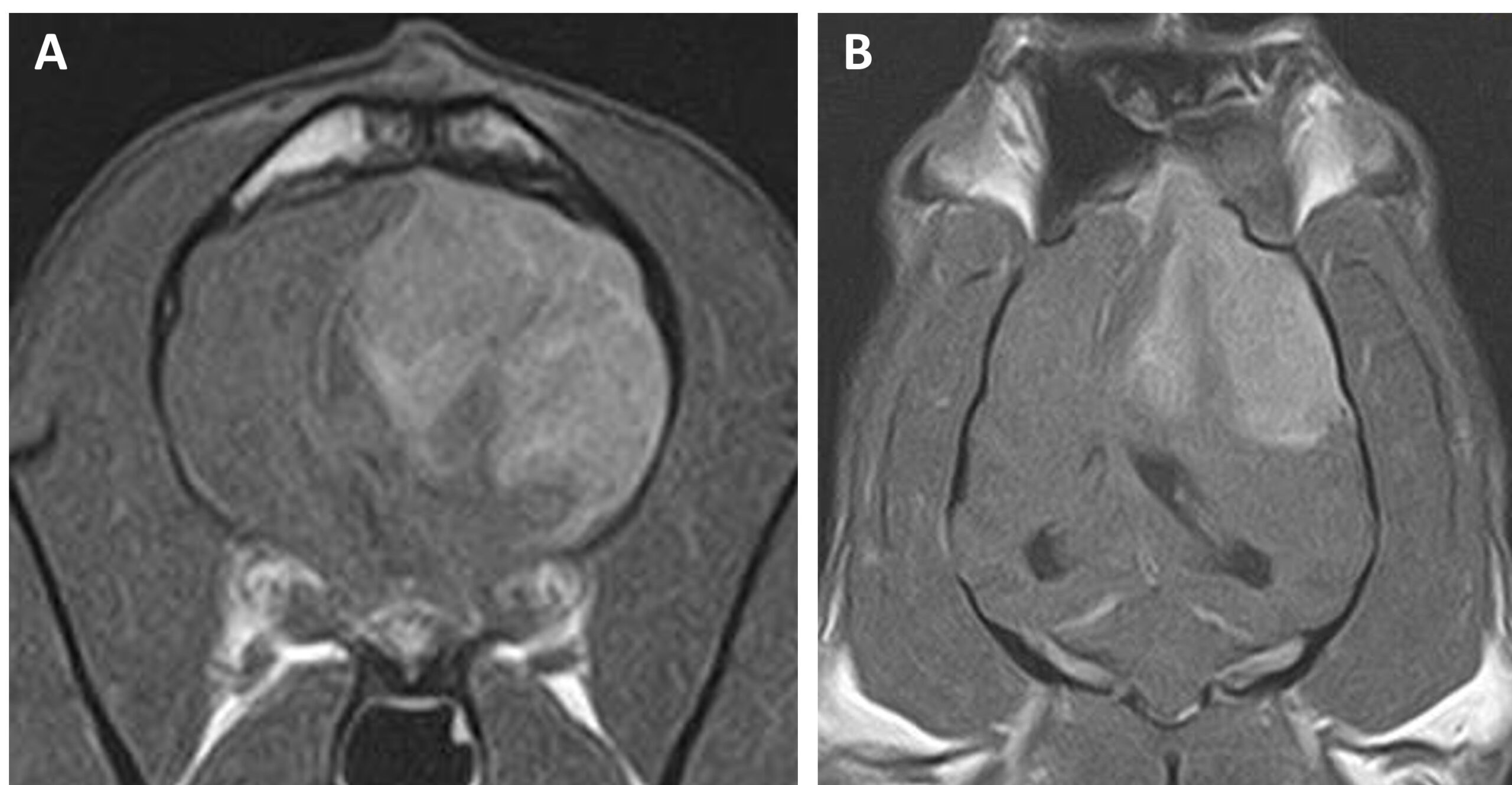
第99天,出现急性嗜睡和腰痛。由于整个右侧大脑半球和部分丘脑在T2WI和FLAIR图像上呈高信号强度,在DWI图像上呈高信号,在ADC图上呈等信号,因此怀疑为脑梗塞(下图)。
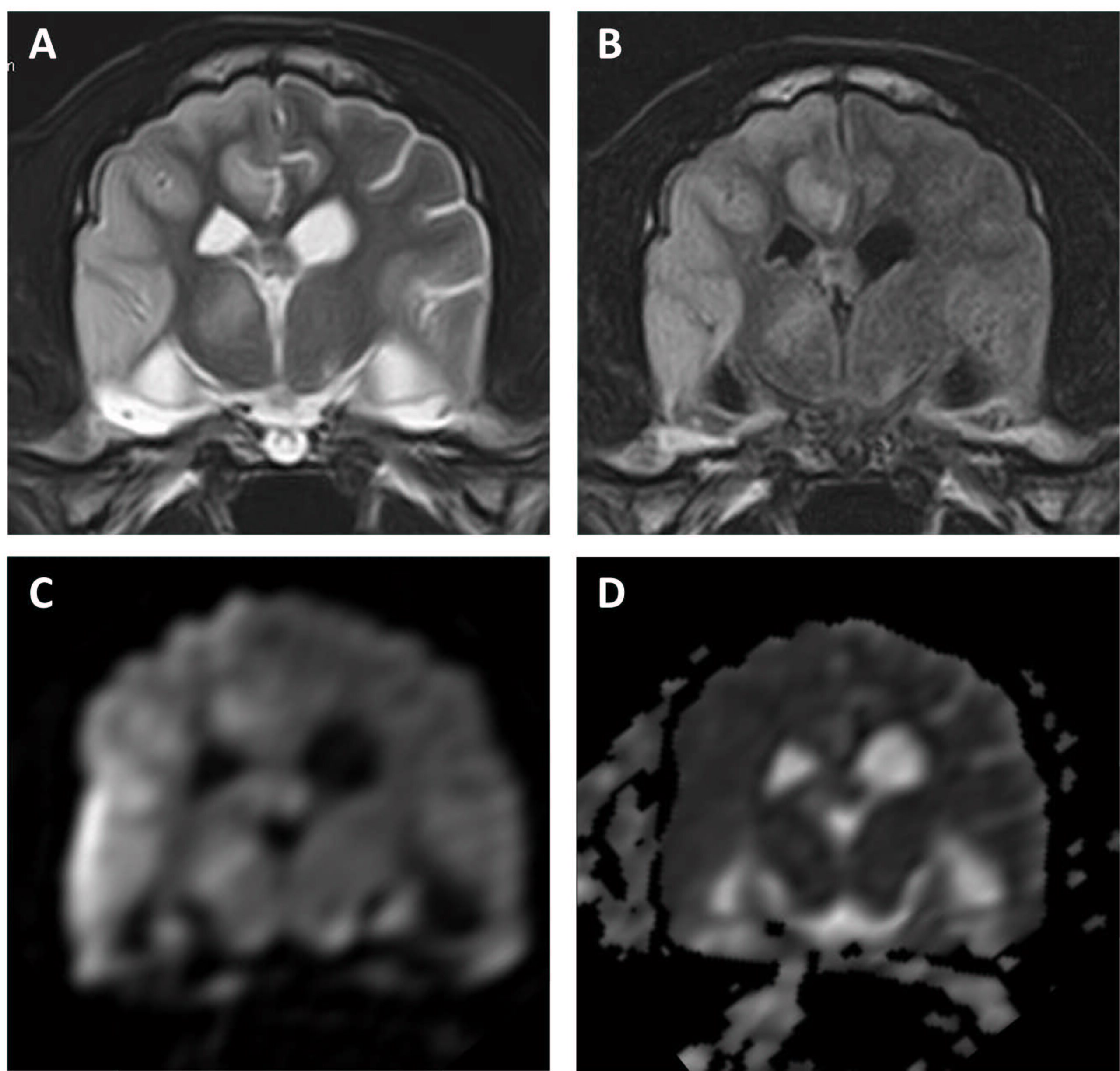
↑ 整个右侧大脑半球和部分丘脑在(A)T2加权和(B)FLAIR图像上显示高信号,在(C)DWI图像上显示高信号,在(D)ADC图上显示等信号。
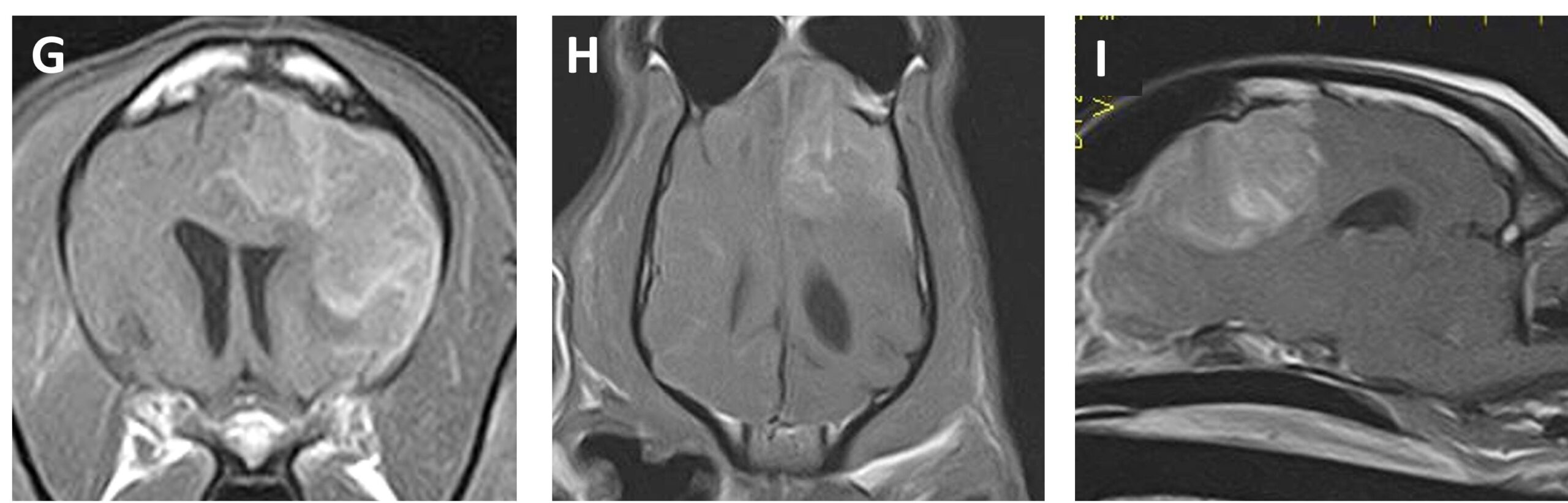
左额叶的组织细胞肉瘤病灶大小为28.1×24.3×22.2 mm,并已明显消退(下图)。开始口服利伐沙班(0.25 mg/kg,每天两次)。患者的神经症状逐渐改善。
第110天,接受了第三次尼莫司汀(20 mg/m2)治疗。
第124天,由于神经系统检查发现面部感觉减退或丧失,怀疑三叉神经损伤,因此进行了MRI。观察到病灶明显再次扩大(下图)。因此将尼莫司汀改为替莫唑胺口服(120-140 mg/m2,每天一次,连续5天),28天为一个周期,分别为第131、153和173天。在此期间,临床症状没有发生重大变化,患者能够行走,但有些不稳。
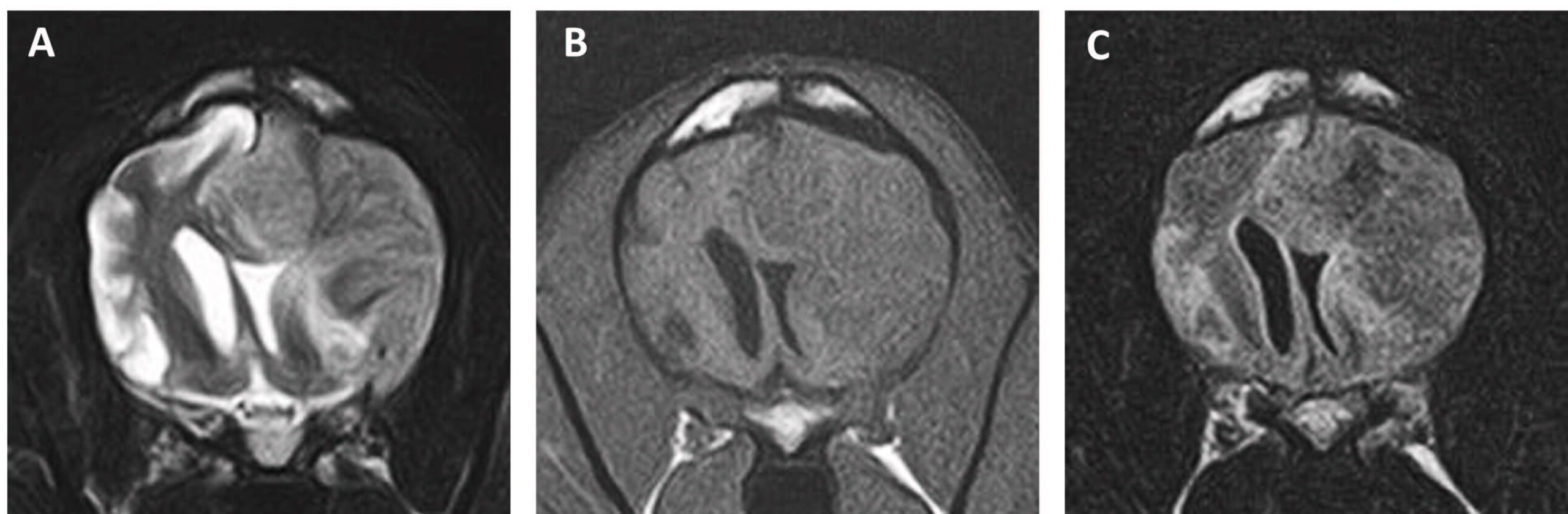
↑ 在(A)T2加权、(B)T1加权和(C)FLAIR图像上观察到病灶再次扩大。
第195天,患者突然死亡。主人拒绝进行病理解剖。
05 讨论
组织细胞肉瘤(Histiocytic sarcoma,HS)是犬中一种不常见的恶性肿瘤,由关节、肺、肝和脾的间质树突状细胞引起[1]。尽管有报道称HS累及中枢神经系统,但大多数病例为播散型,而原发性颅内型则很少见[2]。有报道称,手术、放疗和化疗相结合是治疗HS的有效方法。然而,针对脑内型HS的标准治疗方法仍鲜有描述。
使用洛莫司汀(CCNU)进行全身治疗是犬HS的标准治疗方法,可作为辅助治疗或用于治疗严重病变[3]。尼莫司汀(ACNU)是一种亚硝基脲类烷化剂,与CCNU同属一类,由于能够穿过血脑屏障,在日本被广泛用于治疗人和犬的神经系统肿瘤(如胶质瘤)[4,5]。然而,关于使用ACNU治疗HS的报道却很少,尤其是使用ACNU治疗颅内HS的报道极为有限[6-8]。
犬颅内肿瘤(如胶质瘤)的治疗由先进的成像技术驱动,并涉及手术、化疗和放疗等综合疗法[9]。然而,由于颅内HS的发病率较低,目前尚未制定出最佳的治疗策略[2]。近年来,亚硝基脲类抗癌药物ACNU已被用于治疗HS,并有疗效报告[10]。既往研究在两例颅内HS中使用了这种药物,并获得了超过400天的长期存活[10]。然而,在这两例病例中,都是通过手术切除了大面积病灶,而单独使用ACNU治疗颅内HS大面积病灶的病例尚未见报道。
在本病例中,第二次使用ACNU后,MRI证实肿瘤病灶缩小。CCNU是亚硝基脲家族的一种烷化药物,常用作治疗犬HS的一线药物疗法,对大面积病变的反应率为29%,反应持续时间为96天[11]。
在6只不同部位HS的狗中,使用ACNU作为单药治疗的反应率为50%,中位反应持续时间为48天[5]。在本病例中,使用ACNU可使肿瘤缩小。疗效持续时间很短,仅为84天,但在此期间,临床症状有所改善。
替莫唑胺是一种可穿透血脑屏障的口服烷化剂,已被用于治疗犬颅内胶质瘤[9,12]。替莫唑胺给药没有引起患者临床症状的任何恶化,也没有观察到明显的不良事件。替莫唑胺在犬HS中的应用尚未有报道,其有效性尚不清楚。在人类医学中,手术切除和放射治疗结合替莫唑胺已被用于治疗颅内HS患者,效果良好[13]。需要前瞻性研究来确定替莫唑胺对犬HS的疗效。
泼尼松龙也被用作脑水肿的对症治疗。之前的一份病例报告显示,泼尼松龙对犬颅内HS具有抗肿瘤作用[14]。然而,另一项研究发现,泼尼松龙给药与关节周围HS犬的存活时间缩短有关[15]。因此,泼尼松龙治疗HS的疗效尚不清楚。
总之,本报告描述了在狗身上使用ACNU后,颅内HS的缩小。如果放射治疗无法进行,或者手术切除不充分,ACNU单一疗法可能是治疗犬颅内HS的一种选择。需要进一步的前瞻性研究来阐明ACNU治疗颅内HS的有效性。
文献来源:Tagawa M, Itoi T, Yoshitake R, Kutara K, Akashi N, Mitsui I, Okamura Y. Therapeutic effect of nimustine in a dog with intracranial histiocytic sarcoma. Open Vet J. 2024 Oct;14(10):2700-2706.
参考文献
[1] Moore P.F. A review of histiocytic diseases of dogs and cats. Vet. Pathol. 2014;51:167–184.
[2] Mariani C.L, Jennings M.K, Olby N.J, Borst L.B, Jr Brown J.C, Robertson I.D, Seiler G.S, MacKillop E. Histiocytic sarcoma with central nervous system involvement in dogs: 19 cases (2006–2012) J. Vet. Intern. Med. 2015;29:607–613.
[3] Skorupski K.A, Clifford C.A, Paoloni M.C, Lara-Garcia A, Barber L, Kent M.S, LeBlanc A.K, Sabhlok A, Mauldin E.A, Shofer F.S, Couto C.G, Sørenmo K.U. CCNU for the treatment of dogs with histiocytic sarcoma. J. Vet. Intern. Med. 2007;21:121–126.
[4] Wakabayashi T, Yoshida J, Mizuno M, Kajita Y. Intratumoral microinfusion of nimustine (ACNU) for recurrent glioma. Brain Tumor Pathol. 2001;18:23–28.
[5] Takahashi T, Shiozawa H, Ishizaki T, Okada K, Kondo H. Anaplastic oligodendroglioma with nasal invasion and systemic metastasis in a dog. J. Vet. Med. Sci. 2023;85:1052–1056.
[6] Takahashi M, Goto-Koshino Y, Fukushima K, Kanemoto H, Nakashima K, Fujino Y, Ohno K, Endo Y, Tsujimoto H. Phase I dose-escalation study of nimustine in tumor-bearing dogs. J. Vet. Med. Sci. 2014a;76:895–899.
[7] Takahashi M, Tomiyasu H, Hotta E, Asada H, Fukushima K, Kanemoto H, Fujino Y, Ohno K, Uchida K, Nakayama H, Tsujimoto H. Clinical characteristics and prognostic factors in dogs with histiocytic sarcomas in Japan. J. Vet. Med. Sci. 2014b;76:661–666.
[8] Asada H, Tomiyasu H, Okada K, Chambers J.K, Goto-Koshino Y, Uchida K, Kagawa Y, Ohno K, Tsujimoto H. Clinical significance of the two-base insertion mutation in the TP53 gene in canine histiocytic sarcoma. Res. Vet. Sci. 2019;124:57–60.
[9] José-López R. Chemotherapy for the treatment of intracranial glioma in dogs. Front. Vet. Sci. 2023;10:1273122.
[10] Tani H, Kurita S, Miyamoto R, Sawada H, Fujiwara-Igarashi A, Michishita M, Azakami D, Hasegawa D, Tamura K, Bonkobara M. Nimustine treatment of 11 cases of canine histiocytic sarcoma. J. Am. Anim. Hosp. Assoc. 2020;56:146.
[11] Rassnick K.M, Moore A.S, Russell D.S, Northrup N.C, Kristal O, Bailey D.B, Flory A.B, Kiselow M.A, Intile J.L. Phase II, open-label trial of single-agent CCNU in dogs with previously untreated histiocytic sarcoma. J. Vet. Intern. Med. 2010;24:1528–1531.
[12] Hidalgo Crespo E, FarréMarinéA, Pumarola I Battle M, Borrego MassóJ.F, Luján Feliu-Pascual A. Survival time after surgical debulking and temozolomide adjuvant chemotherapy in canine intracranial gliomas. Vet. Sci. 2022;9:427.
[13] Foster M, Kamaly-Asl I, Stivaros S, Kelsey A, Gattamenini R, Kilday J.P. Primary cerebral histiocytic sarcoma in childhood: a case report of protracted survival and review of the literature. Childs Nerv. Syst. 2015;31:2363–2368.
[14] Takahashi T, Kagawa Y, Ito D. Successful use of prednisolone and radiation therapy in a dog with intracranial histiocytic sarcoma. J. Vet. Med. Sci. 2021;83:1782–1785.[15] Klahn S.L, Kitchell B.E, Dervisis N.G. Evaluation and comparison of outcomes in dogs with periarticular and nonperiarticular histiocytic sarcoma. J. Am. Vet. Med. Assoc. 2011;239:90–96.