
| 一般情况 | |
|---|---|
 | 品种:卡斯罗犬 |
| 年龄:2岁 | |
| 性别:雄 | |
| 是否绝育:否 | |
| 诊断:脉络丛肿瘤 | |
01 主诉及病史
一周前出现进行性行动不便、后肢本体感觉共济失调并伴有脊柱疼痛。
02 检查
神经系统检查显示,患者精神状态正常,后肢呈宽大站立姿势,活动性截瘫明显,后肢出现本体感觉共济失调,姿势反应(爪子放置和跳跃)延迟,脊髓反射正常。
由于患者性情猛烈,无法对其胸肢的姿势反应和脊髓反射进行可靠的评估。颅神经评估结果无异常。触诊头部和椎体多处时发现不适。神经解剖学定位为T3-L3脊髓节段异常。
脊柱MRI显示,在L4-L5和L7-S椎间盘间隙有两个界限清楚、非侵入性、圆形至卵圆形的硬膜外占位性病变,直径分别为1.2×0.8 cm和0.3 cm。与脊髓实质相比,病变在T2w图像中呈明显高密度,在T1w图像中呈等密度至高密度。病变造成脊髓和马尾脊神经压迫,考虑为硬膜内-髓外肿瘤(下图A-C)。在C7椎体水平有一个类似的硬膜内-髓外占位病变,直径为1.2 cm(下图D-I)。
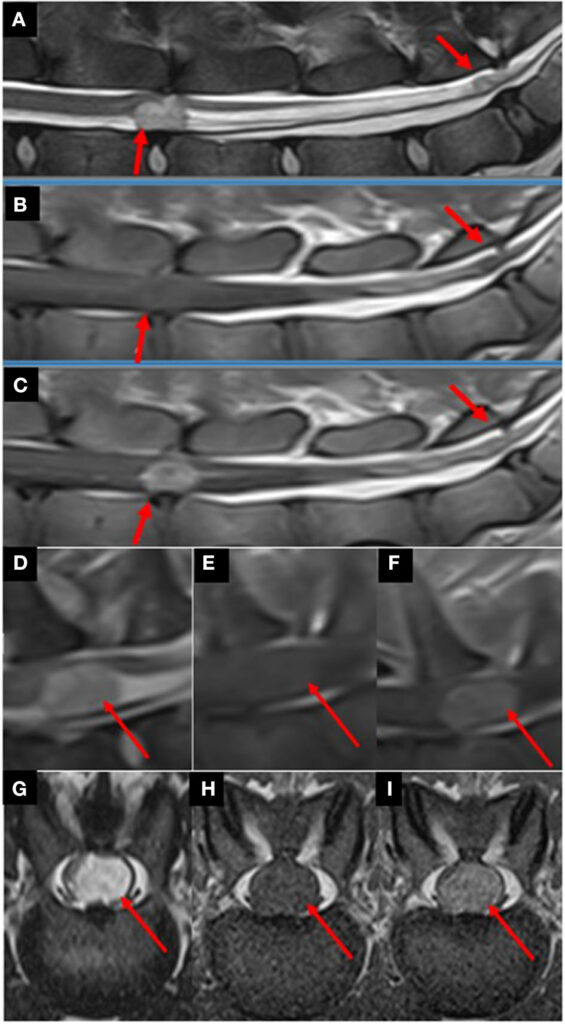
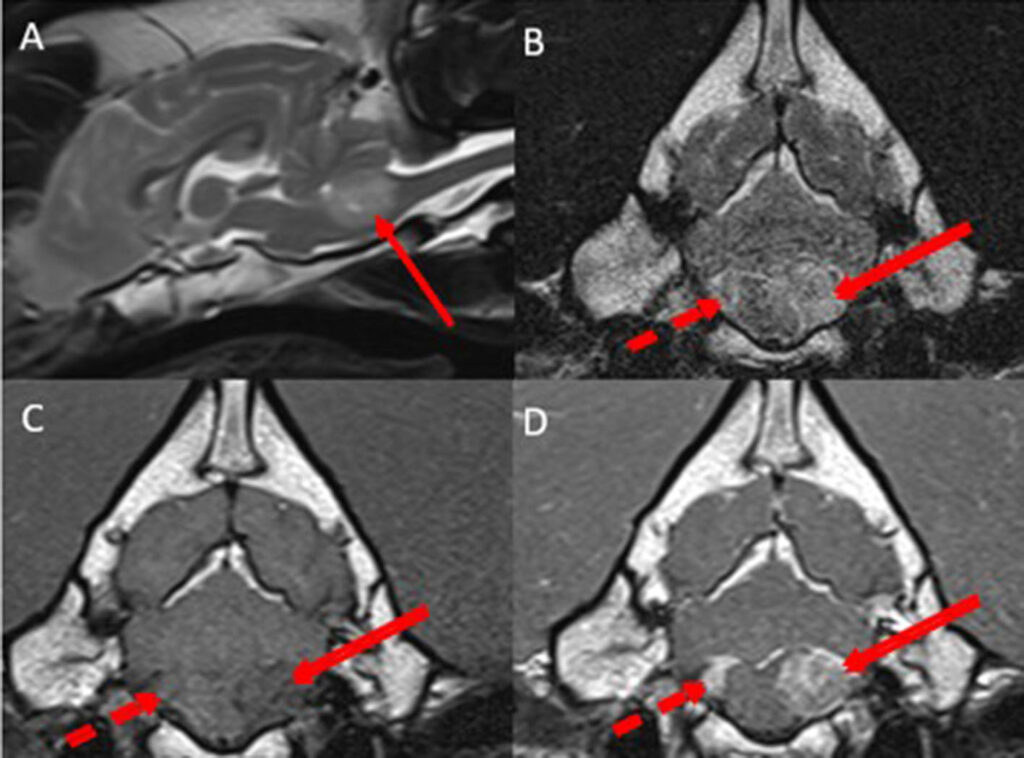
头部MRI显示,第四脑室尾部左侧有一个圆形至卵圆形的脑室内占位性病变,病变延伸至左侧脑室孔,直径为1.8×1.6 cm。与灰质相比,病变在T2w和T2w FLAIR图像中呈高密度,在T1w图像中呈等密度至高密度。病变对小脑和延髓造成中度压迫。在第四脑室的右侧尾部可以观察到一个类似但较小的病灶,延伸至右侧脑室孔(下图)。上述病变均呈明显的对比增强。
03 治疗
由于预后不良和目前生活质量较差,主人选择了安乐死。
04 尸检
大脑左侧有一个直径最大为1 cm的略不规则、柔软的灰色肿块,位于硬脑膜下方,似乎在左外侧孔水平与脑膜分离。该病变压迫了左外侧孔水平的延髓(下图A)。在右侧孔水平也发现了一个类似的占位性病变,但较小。
C7椎体脊髓硬膜下有一个2 cm长的灰色软肿块,导致几乎整个脊髓向左侧背外侧移位。脊髓受到严重压迫(下图B)。在L4-L5椎间盘间隙水平,一个类似的肿块在腹侧和左侧压迫脊髓。在L7-S1椎间盘间隙处,另一个类似的肿块移位了马尾神经,但没有侵犯脊神经。
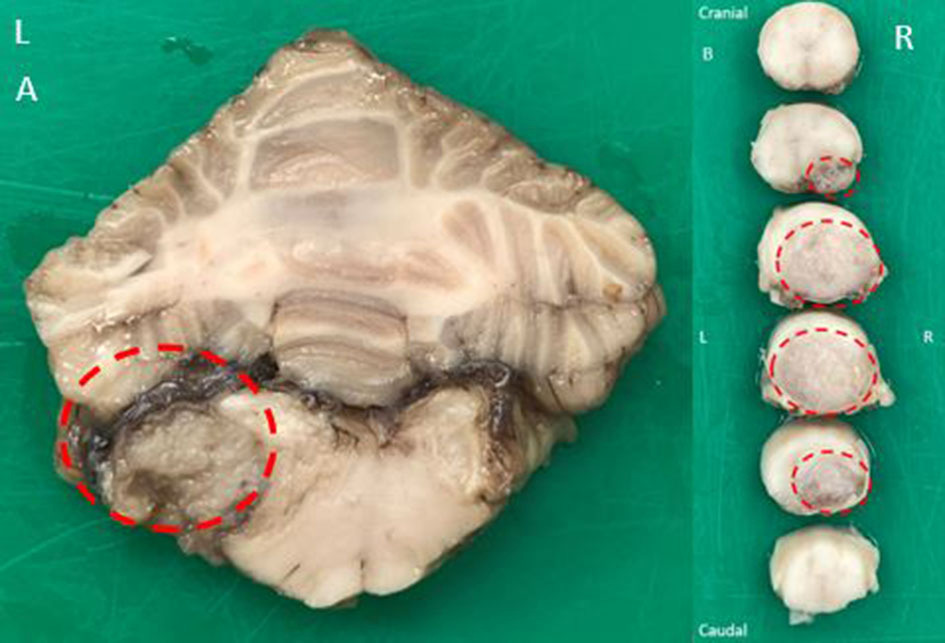
延髓左侧有一个部分包裹、多处浸润、中度细胞性的肿瘤性肿块,起源于该侧第四脑室的脉络丛。虽然死后人工痕迹影响了组织结构的保存,但乳头状形态仍然清晰可见。乳头状形态几乎为单层的,由纤维血管基质支撑,细胞核小且低色素。浸润区细胞核较大,且呈粗条纹状。此外,几乎没有异形细胞和异形核,很少观察到有丝分裂。肿块压迫邻近的延髓,邻近的小脑叶有多灶性嗜酸性粒细胞增多(坏死)。在延髓右侧发现了一个更小的类似肿块(下图)。

脊髓蛛网膜下腔的病变完全相同,组织学检查也显示出相同的硬膜下肿瘤性增生。细胞还形成了更坚实的区域,缺乏支持基质,并出现多灶性坏死。有丝分裂很少。腹侧脊髓动脉出现纤维素性坏死,尤其是在腹侧脊髓束区域,有广泛的空泡化和散布的球形物,硬脑膜呈局灶性骨化。
从形态学上看,肿瘤最符合原发性第四脑室脉络丛乳头状瘤(CPP-I级),CSF滴状转移至脑室(CPP-I级)和脊柱蛛网膜下腔(aCPP-II级)。
05 讨论
脉络丛位于侧脑室、第三脑室和第四脑室,由改良的上皮细胞和峡部血管增生形成,这些细胞参与脑脊液(Cerebrospinal fluid,CSF)进入脑室的被动和主动分泌[1]。脉络丛肿瘤(Choroid plexus tumor,CPT)约占犬中枢神经系统肿瘤的7-10%,46%的CPT会影响第四脑室[2-4]。由于其组织学与人类相似,CPT通常根据WHO的中枢神经系统肿瘤分类系统进行分级[3,5-7]。
WHO将CPT分为三个等级:脉络丛乳头状瘤(CPP,I级)、非典型CPP(aCPP,II级)和脉络丛癌(CPC,III级)[3,5-7]。CPP和aCPP的鉴别基于组织学特征,如有丝分裂增多、细胞增多、核不典型和乳头状形态消失等[5-9]。临床上,CPP和CPC的鉴别涉及CSF分析和MRI特征[2,4,5,8,10]。CSF总蛋白浓度超过80 mg/L和MRI出现CSF滴状转移灶强烈提示CPC[4]。
CSF滴状转移灶是指原发性中枢神经系统肿瘤随CSF向中枢神经系统的蛛网膜下腔和脑室扩散[4,11,12]。在人类医学中,也有继发于CPP的CSF滴状转移的报道,但很少见[13,14]。在兽医文献中,有两篇关于脊髓CPP的病例报告,但未发现原发性CPP[15,16]。仅有两篇报告称在尸检时发现了继发于CPP的单个蛛网膜下腔小转移瘤[4,7]。在这两份报告中,均未观察到MRI显示的转移灶,表明存在继发于CPP的CSF滴状转移灶[4,7]。
目前,兽医文献中还没有证据表明组织学确诊的CPP会导致MRI表现为脑室和脊髓出现CSF滴状转移。本病例报告首次从临床、MRI和组织学角度描述了一只年轻成年犬的原发性CPP以及扩散至脑室和脊柱蛛网膜下腔的CSF滴状转移。
根据一项对56例犬CPT病例的回顾性研究,在MRI上发现扩散到脑室和脊髓蛛网膜下腔的CSF滴状转移是临床上鉴别CPP和CPC的可靠方法[4]。CPP不会出现蛛网膜下腔转移,而 33%的CPC在MRI上发现了蛛网膜下腔转移[4]。但作者报告说,有一名CPP出现了蛛网膜下腔转移,作者没有提供关于转移瘤位置的进一步信息,也没有报告CPP组有任何MRI转移的证据,可以怀疑转移性肿块只是在尸检时偶然发现的。
迄今为止,仅有两例犬的病例报告在MRI上记录了经组织学证实的脊髓蛛网膜下腔CPP[15,17]。在第一份关于脊髓蛛网膜下腔癌手术切除后长期疗效的病例报告中,作者的首次MRI主要用于检查T3-L3脊髓病变[17]。作者发现了硬膜内-髓外间隙占位病变,并对其进行了手术切除和组织学分析。组织学特征与脉络丛乳头状瘤一致。术后4个月再次进行MRI检查,未发现局部复发。然而与最初的MRI相比,发现了一个影响右侧孔的占位性病变,与CPT一致。由于没有颅内体征,因此没有进行进一步检查。患者在术后25个月因颅内体征恶化和癫痫发作而死亡。没有进行尸检以确认疑似的CPT。
在第二份报告中,作者认为患者没有出现颅内体征,因此没有进行头部MRI检查,而脊柱MRI中发现并经手术剥离的脊髓CPP疑似异位来源[15]。然而,正如本病例报告和另一篇关于播散性CPC的病例报告所强调的,没有颅内体征并不能排除没有颅内病变[27]。一些学者建议对疑似CPT病例进行脊髓MRI检查,因为19%的CPC死后有脊髓转移的证据[4]。相反,本病例报告和兽医文献中发表的另外两篇病例报告应提醒临床医生,CPP患者可能不会出现颅内临床症状。对于出现多灶性硬膜内-髓外间隙占位性病变的犬,应进行包括整个中枢神经系统在内的全面而广泛的MRI检查。
本病例报告的不足之处在于没有对CSF进行分析。CSF中的总蛋白浓度被描述为犬死前区分CPC和CPP的标准[4]。CSF中总蛋白浓度升高至80 mg/L以上与CPC诊断一致[4]。本病例报告的另一个局限性是,尸体解剖和组织学检查是在安乐死和福尔马林固定两天后进行的,这可能会造成尸体解剖和/或组织学伪影。
综上,本病例报告首次描述了一只年轻成年犬原发性脑室CPP的临床、MRI和组织学特征,以及扩散到脑室和脊柱蛛网膜下腔的CSF滴状转移。本病例报告应提醒临床医生,没有颅内体征并不能排除没有颅内病变的可能性,并强调了对整个中枢神经系统进行高级成像的重要性,以便为狗主人提供病变的全面情况,即使是疑似原发性良性肿瘤。
参考文献
[1] De Lahunta A, Glass eric, Kent M. Veterinary Neuroanatomy and Clinical Neurology. Amsterdam: Elsevier; (2015).
[2] Wisner ER, Dickinson PJ, Higgins RJ. Magnetic resonance imaging features of canine intracranial neoplasia. Vet Radiol Ultras. (2011) 52:S52–61.
[3] Snyder JM, Shofer FS, Van Winkle TJ, Massicotte C. canine intracranial primary neoplasia: 173 Cases (1986-2003). J Vet Intern Med. (2006) 20:669–75.
[4] Westworth DR, Dickinson PJ, Vernau W, Johnson EG, Bollen AW, Kass PH, et al.. Choroid plexus tumors in 56 dogs (1985-2007). J Vet Intern Med. (2008) 22:1157–65.
[5] Miller AD, Miller CR, Rossmeisl JH. Canine primary intracranial cancer: a clinic pathologic and comparative review of glioma, meningioma, and choroid plexus tumors. Front Oncol. (2019) 9:1151.
[6] Muscatello LV, Avallone G, Serra F, Seuberlich T, Mandara MT, Sisó S, et al.. Glomeruloid microvascular proliferation, desmoplasia, and high proliferative index as potential indicators of high-grade canine choroid plexus tumors. Vet Pathol. (2018) 55:391–401.
[7] Reginato A, Girolami D, Menchetti L, Foiani G, Mandara MT. E-cadherin, N-cadherin expression and histologic characterization of canine choroid plexus tumors. Vet Pathol. (2016) 53:788–91.
[8] Vandevelde M, Higgins R, Oevermann A. Veterinary Neuropathology, Essentials of Theory and Practice. New York, NY: John Wiley & Sons; (2012), p. 142–3.
[9] Ribas JL, Mena H, Braund KG, Sesterhenn IA. A histologic and immune cytochemical study of choroid plexus tumors of the dog. Vet. Pathol. (1989) 26:55–64.
[10] Mai W. Diagnostic MRI in Dogs and Cats. London: CRC Press; (2018), 219–220.
[11] Bentley RT, Yanke AB, Miller MA, Heng HG, Cohen-Gadol A, Rossmeisl JH. Cerebrospinal Fluid Drop Metastases of Canine Glioma: Magnetic Resonance Imaging Classification. Front Vet Sci. (2021) 8: 650320.
[12] Vigeral M, Bentley RT, Rancilio NJ, Miller MA, Heng HG. Imaging diagnosis —antemortem detection of oligodendroglioma “cerebrospinal fluid drop metastases” in a dog by serial magnetic resonance imaging. Vet Radiol Ultrasound. (2018) 59:E32–7.
[13] Leblanc R, Melanson D, Carpenter S. Diffuse cranio spinal seeding from a benign fourth ventricle choroid plexus papilloma Case report. J. Neurosurg. (1998) 88:757–60.
[14] McCall T, Binning M, Blumenthal DT, Jensen RL. Variations of disseminated choroid plexus papilloma: 2 case reports and a review of the literature. Surg Neurol. (2006) 66:62–7.
[15] Giannuzzi AP, Gernone F, Ricciardi M, et al.. A sacro-caudal spinal cord choroid plexus papilloma in a shar-pei dog. Journal of Small Animal Practice. (2013) 54:551–4.
[16] Tabanez J, Beck S, Driver C, Rusbridge C. Spinal ectopic choroid plexus papilloma in a cat. Journal of Feline Medicine and Surgery Open Reports. 2021;7(2).
[17] Saitoh Y, Aikawa T, Miyazaki Y, Nishimura M. Long-term outcome after surgical resection of a spinal choroid plexus tumor in a dog. JAAHA. (2021) 57:37–41.
[18] Gaudio RM, Tacconi L, Rossi MLM. Pathology of choroid plexus papillomas: a review. Clin Neurol Neurosurg. (1998) 100:165–86.
[19] Espino L, Suarez M, Santamarina G, Vila M, Miño N, Lopez-Peña M. First report of the simultaneous occurrence of choroid plexus papilloma and meningioma in a dog. Acta Vet Hung. (2009) 57:389–97.
[20] Antonakakis MG, Carletti BE, Anselmi C, McGrath S, Minguez JJ. Use of a telovelar approach for complete resection of a choroid plexus tumor in a dog. Vet Surg. (2022) 51:1273–9.
[21] Oura TJ, Early PJ, Jennings SH, Lewis MJ, Tobias JR, Thrall DE. Canine choroid plexus tumor with intracranial dissemination presenting as multiple cystic lesions. Case Rep Veter Med. (2013) 2013:1–4.
[22] Kurtz HJ, Hanlon GF. Choroid plexus papilloma in a dog. Vet Path. (1971) 8:6–15.
[23] Itoh T, Uchida K, Nishi A, Shii H, Nagayoshi T, Sakamoto H. Choroid plexus papilloma in a dog surviving for 15 months after diagnosis with symptomatic therapy. J Vet Med Sci. (2016) 78:167–9.
[24] Skerritt GC, Whitbread TJ. Two cases of paradoxical vestibular syndrome in rough collies. J Small Anim Prac. (1985) 26:603–11.
[25] Eisenrerg HM, Mccomb JG, Lorenzo AV. Cerebrospinal fluid overproduction and hydrocephalus associated with choroid plexus papilloma. J Neurosurg. (1974) 40:38.
[26] Rekate HL, Erwood S, Brodkey JA, Chizeck HJ, Spear T, Ko W. Etiology of ventriculomegaly in choroid plexus papilloma. Pediatric Neurosurg. (1985) 12:196–201.
[27] Yeamans CL, Gutierrez-Quintana R, Haley A, Lamm CG. Magnetic resonance imaging and clinical findings associated with choroid plexus spinal cord “drop” metastases. J Am Anim Hosp Assoc. (2017) 53:265–9.