
| 品种:法国斗牛犬 | |
| 年龄:12岁 | |
| 性别:雌 | |
| 诊断:肺原发副神经节瘤 | |
01 主诉及病史
体检进行的胸部X线检查发现左胸部肿块。
没有任何临床症状,全身状况良好。
02 检查
体重12.2千克。体温38.3°C,心率100次/分,呼吸40次/分。收缩压168 mmHg,平均动脉血压124 mmHg,舒张压119 mmHg。全血细胞计数未发现异常。
血生化显示轻度高胆固醇血症(474 mg/dl),碱性磷酸酶(629 U/l)和丙氨酸氨基转移酶(86 U/l)轻度升高,血尿素氮轻度降低(7.5 mg/dl)。
表现为多尿及烦渴。在促肾上腺皮质激素刺激试验中,皮质醇后水平为27.8 µg/dl。因此确定该犬可能有库欣综合征。
CT造影显示肿块(42×39×44 mm)位于左尾肺叶基底部。肿块与左颅肺叶接触,在静脉期对比增强,在平衡期被迅速冲淡(下图)。
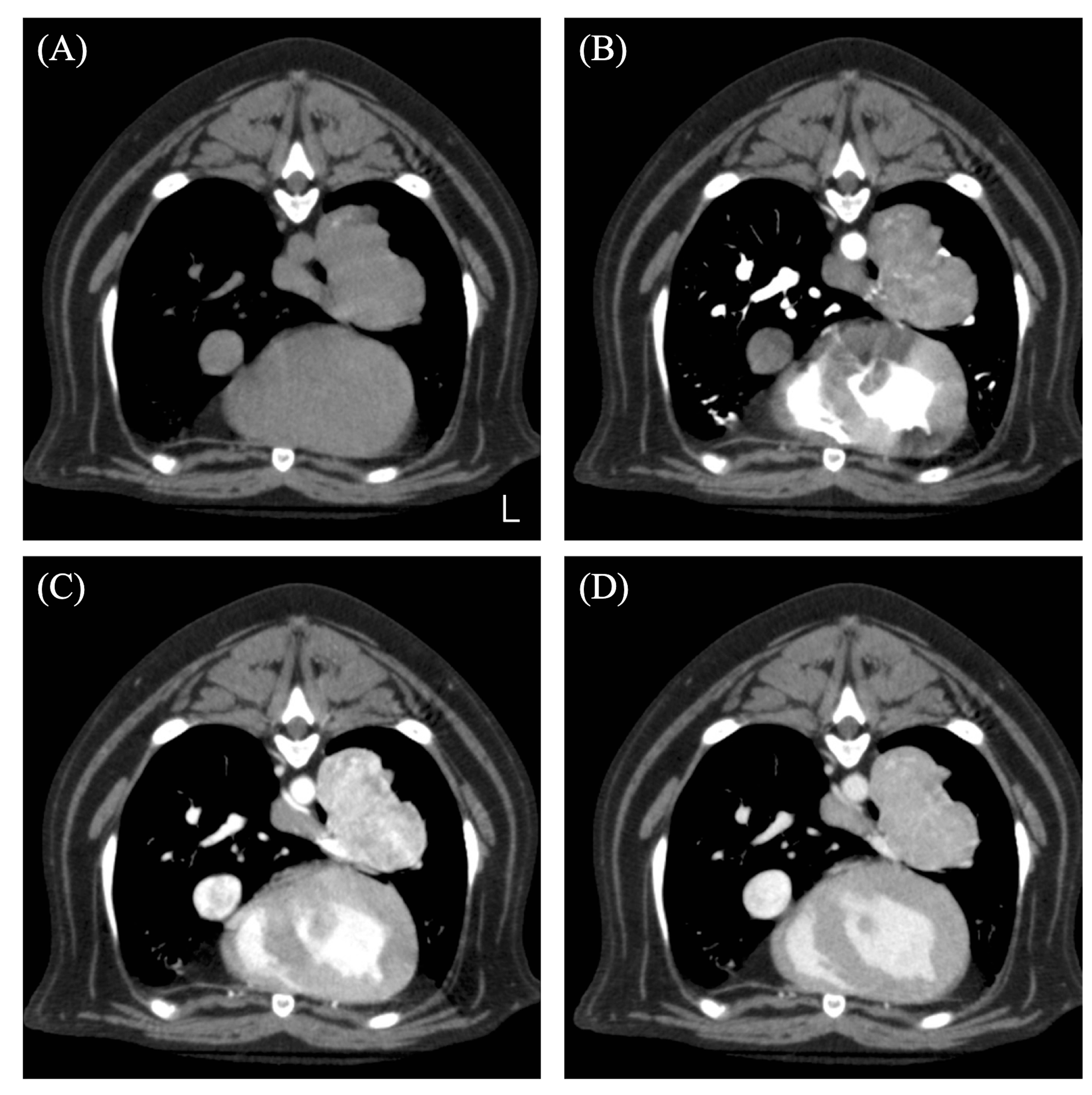
↑ 胸部CT图像。(A)平扫,(B)动脉期,(C)静脉期,(D)平衡期。肿块与左颅肺叶接触,在静脉期呈强对比增强,在平衡期被迅速冲淡。
右支气管中段淋巴结肿大,对比度增强模式与左尾肺叶肿块相似(下图)。
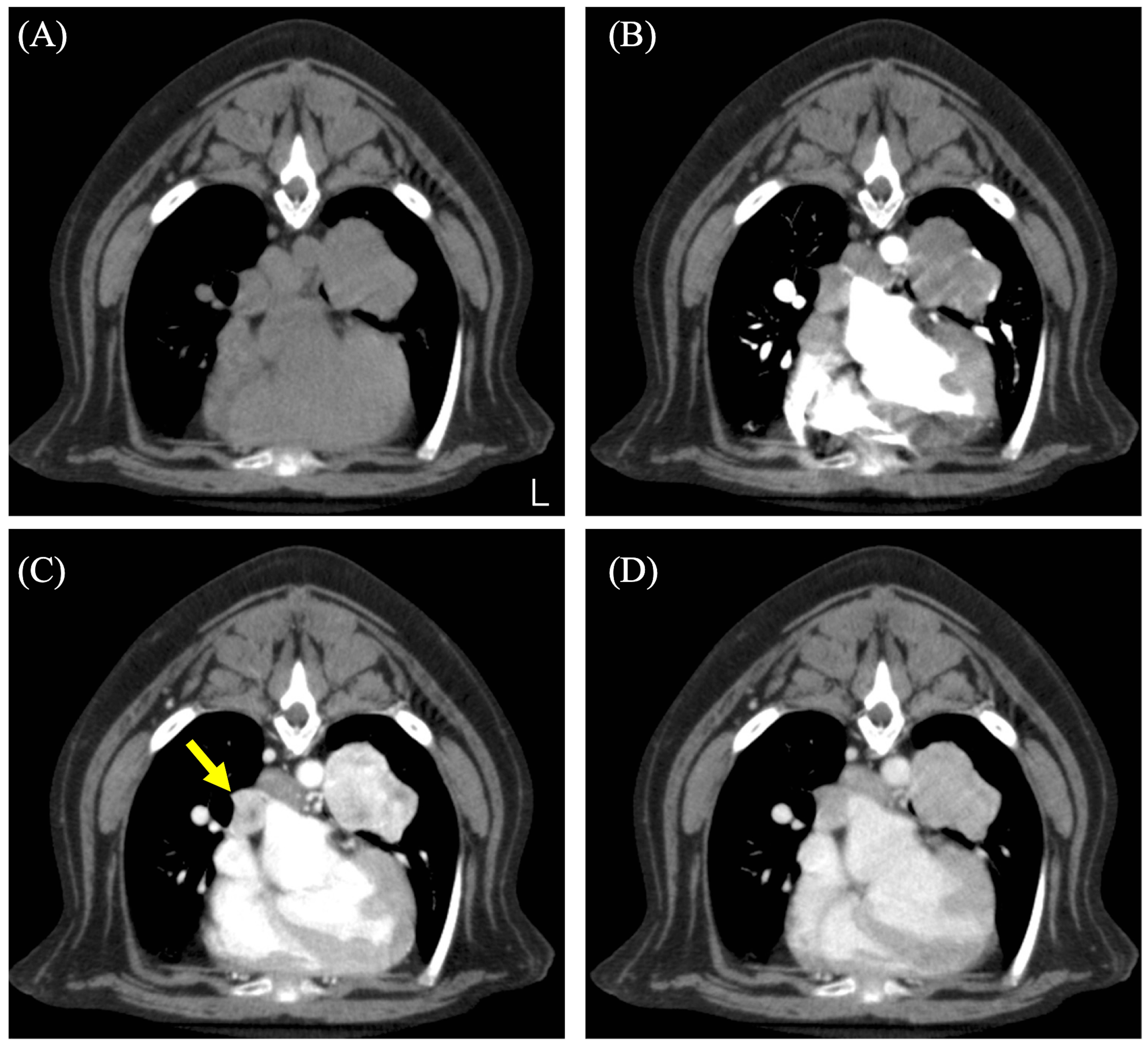
↑ 胸部CT图像。(A)平扫,(B)动脉期,(C)静脉期,(D)平衡期。黄色箭头表示右支气管中段淋巴结。淋巴结在静脉期呈强对比增强,在平衡期被迅速冲淡。肺部肿瘤的平均CT值在动脉期为72.01 HU,静脉期为206.57 HU,平衡期为132.17 HU。
还观察到右肾上腺肿大,增大至10 mm,呈球形,边缘光滑,边缘处对比增强,静脉期达峰值,平衡期减弱(下图)。根据CT检查结果,初步诊断为原发性肺神经内分泌肿瘤伴淋巴结转移。
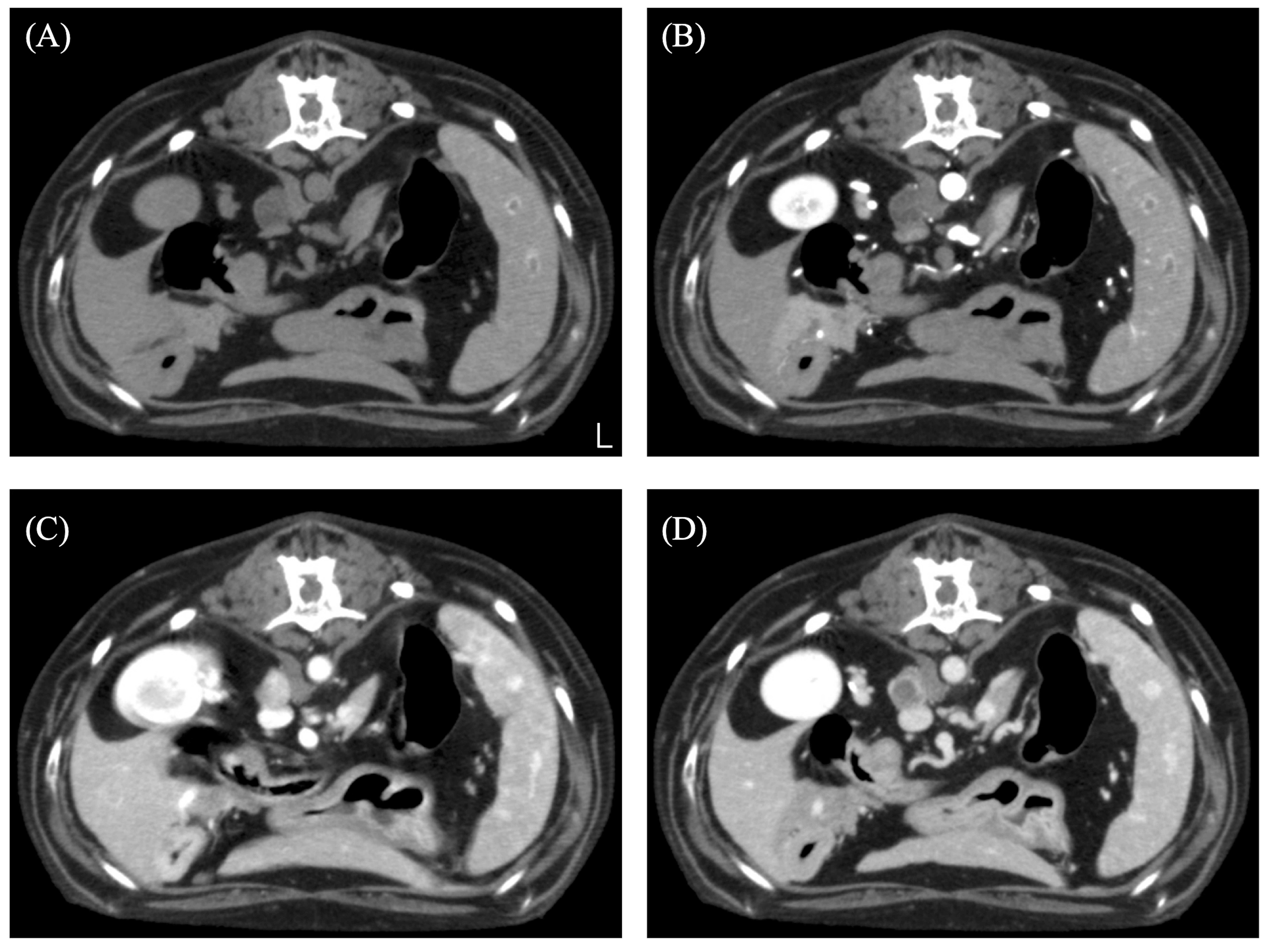
↑ 腹部CT图像。(A)平扫,(B)动脉期,(C)静脉期,(D)平衡期。右肾上腺呈球形,边缘光滑,边缘处对比度增强,静脉期呈峰值,平衡期呈衰减。肾上腺肿瘤的平均CT值在动脉期为22.23 HU,静脉期为87.58 HU,平衡期为48.21 HU。
03 治疗
第51天,接受了左侧尾肺叶切除术。
皮下注射阿托品(40μg/kg)进行预处理,静脉注射芬太尼(3μg /kg)和氯胺酮(0.5 mg/kg)。静脉注射丙泊酚诱导全身麻醉,并在注射芬太尼和氯胺酮的同时使用丙泊酚维持麻醉。用0.5%布比卡因在左胸壁第5-7肋间隙进行神经刺激引导下的椎旁阻滞。经皮插管右侧足背动脉,使用24号导管进行有创动脉压测量。留置导尿管用于测量术中尿量。
手术通过打开左侧第5肋间进行。开胸后,确定了左侧尾肺叶肿块,并按照以下顺序处理了血管系统:肺动脉、左侧颅肺叶的大叶支气管和肺静脉。肺动脉和肺叶支气管的检查在处理过程中没有任何问题。
在肺静脉结扎操作过程中,突然出现严重高血压(收缩压275 mmHg、平均动脉压212 mmHg、舒张压181 mmHg)。由于怀疑发生了高血压危象,接受了钙通道阻滞剂尼卡地平(10 μg/kg静脉注射)降压治疗,血压改善(收缩压132 mmHg、平均动脉压94 mmHg、舒张压75 mmHg),然后手术继续进行。
为了使血流动力学稳定,同时开始输注美托咪定和尼卡地平,剂量分别为1和5μg/kg/h。尽管如此,由于在进行肿块处理过程中反复出现高血压(收缩压>200 mmHg),因此需要再次静脉注射尼卡地平进行降压治疗。随着肿块血管处理的进行,高血压缓解,血压稳定(收缩压111 mmHg、平均动脉压74 mmHg、舒张压58 mmHg)。切除面无明显出血或漏气。胸部闭合,手术结束。
组织病理学检查显示,立方体至多边形细胞密集排列成条索状或带状。增殖的细胞核呈圆形至椭圆形,细胞质、嗜酸性和嗜碱性颗粒适中。血管中可见肿瘤细胞浸润。免疫组化染色显示,肿块的神经内分泌标志物突触素和嗜铬粒蛋白A呈强阳性,诊断为神经内分泌癌(下图)。
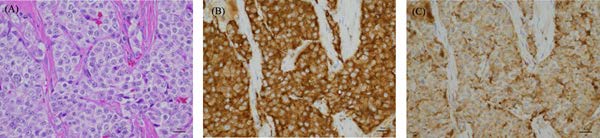
↑ 肺肿块的高倍显微镜图像。(A)肿块由密集的多面体细胞组成,被纤维血管基质分隔。肿瘤细胞核呈圆形,嗜酸性颗粒状胞质适度丰富。细胞有中度异型性,核染色质呈粗颗粒状,有1-2个小核仁。肿瘤细胞的突触素(B)和嗜铬粒蛋白A(C)呈弥漫性阳性。
04 预后
术后状况良好,术后3天出院。
由于术中出现了高血压危象,因此利用术前从导尿管收集的尿液样本测量了留置尿中的甲氧基肾上腺素(MN)和非甲氧基肾上腺素(NMN)水平。术前尿MN/肌酐(Cre)比值为904 [0-120],NMN/Cre比值为6299 [7-124],均异常偏高。
术后1个月,再次采集尿液样本,MN/Cre比值为24,NMN/Cre比值为266,均低于术前。因此,切除的肺部肿瘤被诊断为儿茶酚胺分泌型神经内分泌癌,肺部肿瘤被诊断为原发性副神经节瘤。
术后580天,该犬仍然存活,但主人无法进行积极的术后观察,包括CT扫描。该犬继续表现出库欣综合征的症状,但没有呼吸道症状。
05 讨论
狗肺肿瘤的发病率很低,不到1%[1,2]。肺癌是犬最常见的肺肿瘤(87.1%)[3],也有罕见的神经内分泌肿瘤的报道[3,4]。犬肺部神经内分泌肿瘤很少,临床资料也很有限。
犬神经内分泌肿瘤一般包括儿茶酚胺分泌肿瘤,其中最常见的是肾上腺嗜铬细胞瘤[5]。肾上腺外产生儿茶酚胺的肿瘤被称为副神经节瘤[6],关于狗副神经节瘤的报道很少[7-10]。虽然有嗜铬细胞瘤肺转移的报道,但还没有关于肺部原发副神经节瘤的报道[5]。
有报告称,狗的副神经节瘤起源于舌头、心脏、腹膜后和膀胱[7-10]。之前有报道称犬副神经节瘤会引起厌食和嗜睡等临床症状[10],但临床症状因发病部位而异[7-11]。
手术切除是副神经节瘤首选的治疗方法[9,10,12,13]。副神经节瘤的最长存活时间据报道为670天[8,14],而肺神经内分泌肿瘤的存活时间为11个月[15]。
在该病例中,CT显示左侧尾肺叶肿块、支气管中段淋巴结肿大和右肾上腺肿块。肺部肿块在静脉期强烈强化,在平衡期被冲淡。之前的一项研究报告了10只狗的副神经节瘤CT结果,显示动脉期和静脉期对比度增强很强[16]。本病例中左侧尾肺叶肿块的强对比增强效应和随后的冲淡是怀疑神经内分泌肿瘤的特征性成像结果,除副神经节瘤外,还可见于胰岛素瘤和类癌[17,18]。
切除的肺部肿块经病理检查确诊为神经内分泌癌,与影像学检查结果一致。肿大的右侧支气管淋巴结显示出与肿块相同的对比模式,被怀疑是转移瘤。虽然本病例中未切除右肾上腺肿块,但有报道称肾上腺肿块可在术前通过三相螺旋CT进行诊断[19]。
在本病例中,右肾上腺肿块大小为10 mm,边缘光滑,边缘处对比度增强,在静脉期达到峰值,在平衡期减弱。根据以往的报告,右肾上腺肿块被认为是肾上腺腺瘤,而不是嗜铬细胞瘤。在本病例中,血液检查显示碱性磷酸酶水平升高,这可能是皮质类固醇所致。因此,根据这些结果,左肺肿块不太可能是右肾上腺肿块的转移灶,而被认为是原发性肺肿块。
虽然该病例的影像学检查结果显示是神经内分泌肿瘤,但直到切除左肺肿块时出现高血压危象,才怀疑是儿茶酚胺分泌性肿瘤。高血压危象是嗜铬细胞瘤和副神经节瘤的一种并发症[20,21]。在肿块切除过程中,由于儿茶酚胺的释放,该犬突然出现了严重的高血压。由于当时没有酚苄明,因此采用了血管选择性钙通道阻滞剂尼卡地平来替代酚苄明进行降压抢救。
尼卡地平常用于围手术期的高血压急症以及控制人类患者因嗜铬细胞瘤诱发的高血压[22-24]。有报告称,在狗身上使用尼卡地平对实验诱导的高血压进行降压治疗,结果表明这种药物是有用的[25]。本病例表明,尼卡地平也可成功缓解犬产生儿茶酚胺的神经内分泌癌诱发的高血压。切除手术完成后,血压趋于稳定。
在该病例中测得的尿中甲氧基肾上腺素(MN)和非甲氧基肾上腺素(NMN)水平有助于区分嗜铬细胞瘤[26]。该犬的MN/Cre比值高达904,NMN/Cre比值高达6299,表明该肺部肿块是一种儿茶酚胺分泌性肿瘤。该犬还有一个右肾上腺肿块,不排除肾上腺肿块释放儿茶酚胺的可能性。不过,根据影像结果来看,这种可能性不大。因此,在切除肺部肿块后的1个月复查中,儿茶酚胺水平有所下降。因此,与术中高血压危象相关的儿茶酚胺释放被认为来源于左肺肿块。根据这些结果,患者被诊断为原发性肺副神经节瘤。
术后,NMN/Cre比值轻度升高至266,这可能反映了肺部肿块在支气管中部淋巴结的转移结果。无论属于哪种亚型,肺肿瘤通常都没有症状[27]。然而,当术前CT怀疑是神经内分泌肿瘤时,可在术前测量尿MN和NMN水平,以评估儿茶酚胺生成潜能。
这些术前检查可预测因术中操作导致的高血压的发生,从而有助于围手术期更安全的管理。为准确诊断原发性肺副神经节瘤,还应在术后测量尿液中的MN和NMN水平。
文献来源:Goda Y, Mizutani S, Akashi N, Kanda T, Kutara K, Okamura Y, Asanuma T. A case of primary pulmonary paraganglioma in a dog. Open Vet J. 2024 Oct;14(10):2714-2720.
参考文献
[1] Brodey R.S, Craig P.H. Primary pulmonary neoplasms in the dog: a review of 29 cases. J. Am. Vet. Med. Assoc. 1965;147:1628–1643.
[2] Moulton J.E, von Tscharner C, Schneider R. Classification of lung carcinomas in the dog and cat. Vet. Pathol. 1981;18:513–528.
[3] McPhetridge J.B, Scharf V.F, Regier P.J, Toth D, Lorange M, Tremolada G, Dornbusch J.A, Selmic L.E, Bae S, Townsend K.L, McAdoo J.C, Thieman K.M, Solari F, Walton R.A, Romeiser J, Tuohy J.L, Oblak M.L. Distribution of histopathologic types of primary pulmonary neoplasia in dogs and outcome of affected dogs: 340 cases (2010-2019) J. Am. Vet. Med. Assoc. 2021;260:234–243.
[4] Saegusa S, Yamamura H, Morita T, Hasegawa A. Pulmonary neuroendocrine carcinoma in a four-month-old dog. J. Comp. Pathol. 1994;111:439–443.
[5] Barthez P.Y, Marks S.L, Woo J, Feldman E.C, Matteucci M. Pheochromocytoma in dogs: 61 cases (1984–1995) J. Vet. Intern. Med. 1997;11:272–278.
[6] Lunn K.F, Boston S.E. Tumors of the endocrine system. In: Vail D.M, Thamm D.H, Liptak J.M, editors. In Withrow and MacEwen’s small animal clinical oncology. 6th. St. Louis, MO: Elsevier; 2020. pp. 565–575.
[7] Ilha M.R.S, Styer E.L. Extra-adrenal retroperitoneal paraganglioma in a dog. J. Vet. Diagn. Invest. 2013;25:803–806.
[8] Rodrigues F.R.N, da Silva Freire J.M, Fidelis L.A.P, Pereira A.A.B.G, de Sousa D.E.R, Wilson T.M, Soto-Blanco B, de Castro M.B. Paraganglioma of the tongue in a Chow Chow dog: a comparison with the human counterpart and literature review. Front. Vet. Sci. 2020;7:422.
[9] Park Y.T, Minamoto T. Laparoscopic resection of retroperitoneal paraganglioma close to caudal vena cava in a dog. Vet. Med. Sci. 2021;7:2191–2197.
[10] Hu S.P, Zhang Z, Xiao F, Huang J.N, Jiang Y, Mao D.S, Wang J.F, He X.J. Paraganglioma of the urinary bladder in a dog. J. Comp. Pathol. 2022;195:1–6.
[11] Wilson T.M, Soto-Blanco B. Paraganglioma of the tongue in a Chow Chow dog: a comparison with the human counterpart and literature review. Front. Vet. Sci. 2020;7:422.
[12] Yanagawa H, Hatai H, Taoda T, Boonsriroj H, Kimitsuki K, Park C.-H, Oyamada T. A canine case of primary intra-right atrial paraganglioma. J. Vet. Med. Sci. 2014;76:1051–1053.
[13] Tamura J, Yoshida S, Nagata N, Shimbo G, Oyama N. Successful treatment of acute respiratory failure following hypertensive crisis in a dog with presumed pheochromocytoma or paraganglioma. Open Vet. J. 2023;13:1465–1470.
[14] Robat C, Houseright R, Murphey J, Sample S, Pinkerton M. Paraganglioma, pituitary adenoma, and osteosarcoma in a dog. Vet. Clin. Pathol. 2016;45:484–489.
[15] Choi U.S, Alleman A.R, Choi J.H, Kim H.W, Youn H.J, Lee C.W. Cytologic and immunohistochemical characterization of a lung carcinoid in a dog. Vet. Clin. Pathol. 2008;37:249–252.
[16] Gombert A, Diana A, Hecht S, Nicoli S, Fracassi F, Mortier J, Reyes-Gomez E, Pey P. Imaging features of retroperitoneal extra-adrenal paragangliomas in 10 dogs. Vet. Radiol. Ultrasound. 2022;63:393–402.
[17] Fukushima K, Fujiwara R, Yamamoto K, Kanemoto H, Ohno K, Tsuboi M, Uchida K, Matsuki N, Nishimura R, Tsujimoto H. Characterization of triple-phase computed tomography in dogs with pancreatic insulinoma. J. Vet. Med. Sci. 2016;77:1549–1553.
[18] Kutara K, Konno T, Kondo H, Yamazoe H, Matsunaga S. Triple-phase helical computed tomography of an arterio-hepatic venous shunt in a hepatic tumor in a dog. J. Vet. Med. Sci. 2017;79:1947–1951.
[19] Yoshida O, Kutara K, Seki M, Ishigaki K, Teshima K, Ishikawa C, Iida G, Edamura K, Kagawa Y, Asano K. Preoperative differential diagnosis of canine adrenal tumors using triple-phase helical computed tomography. Vet. Surg. 2016;45:427–435.
[20] Galac S, Korpershoek E. Pheochromocytomas and paragangliomas in humans and dogs. Vet. Comp. Oncol. 2017;15:1158–1170.
[21] Ng D.Z, Than Yu K.P, Rajkanna J. Acute pulmonary edema as a cardiovascular manifestation of pheochromocytoma. Cureus. 2023;15:e33675.
[22] Arai T, Hatano Y, Ishida H, Mori K. Use of nicardipine in the anesthetic management of pheochromocytoma. Anesth. Analg. 1986;65(6):706–708.
[23] Biassoni R, Di Marco E, Squillario M, Barla A, Piccolo G, Ugolotti E, Gatti C, Minuto N, Patti G, Maghnie M, d’Annunzio G. Gut microbiota in T1DM-onset pediatric patients: machine-learning algorithms to classify microorganisms as disease linked. J. Clin. Endocrinol. Metab. 2020;105(9):407.
[24] Groeben H, Walz M.K, Nottebaum B.J, Alesina P.F, Greenwald A, Schumann R, Hollmann M.W, Schwarte L, Behrends M, Rössel T, Groeben C, Schäfer M, Lowery A, Hirata N, Yamakage M, Miller J.A, Cherry T.J, Nelson A, Solorzano C.C, Gigliotti B, Wang T.S, Wietasch J.K.G, Friederich P, Sheppard B, Graham P.H, Weingarten T.N, Sprung J. International multicentre review of perioperative management and outcome for catecholamine-producing tumours. Br. J. Surg. 2020;107(2):e170–e178.
[25] Akashi N, Murahata Y, Tsuno S, Kanazawa A, Hikasa Y, Imagawa T. Nicardipine constant rate infusion alleviates the cardiovascular effects of dexmedetomidine infusions without affecting the minimal alveolar concentration in sevoflurane-anesthetized dogs. Res. Vet. Sci. 2024;172:105254.
[26] Sasaki N, Ikenaka Y, Inoue Y, Ichise T, Nagata N, Ishizuka M, Nakayama S.M, Nakamura K, Takiguchi M. Urinary free metanephrines measurement in dogs with adrenal gland diseases using a new simple liquid chromatography tandem mass spectrometry method. J. Vet. Med. Sci. 2021;83:648–655.
[27] Ogilvie G.K, Haschek W.M, Withrow S.J, Richardson R.C, Harvey H.J, Henderson R.A, Fowler J.D, Norris A.M, Tomlinson J, McCaw D. Classification of primary lung tumors in dogs: 210 cases (1975-1985) J. Am. Vet. Med. Assoc. 1989;195:106–108.