
| 品种:西班牙水犬 | |
| 年龄:7岁 | |
| 性别:雌 | |
| 诊断:巨食管 | |
01 主诉及病史
一年来体重逐渐减轻,并出现反胃症状。
在过去5个月中,体重从17.4千克降至13.6千克。反流物的主要成分是黄色胆汁。
02 检查
体重14千克。血液学和血清酶(ALT、AST、GGT、碱性磷酸酶)、尿素、钙、磷、白蛋白、总蛋白、胆固醇、甘油三酯、葡萄糖、总胆红素、肌酐均正常。没有进行重症肌无力检测,因为肢体活动良好。
X光片显示胃十二指肠部位扩张,怀疑可能是异物堵塞导致的肠蠕动减弱。第2天,进行了钡造影X光检查,观察到钡在给药后7小时仍滞留在食道中。
03 治疗及预后
在使用促动力药(甲氧氯普胺,3 mL/12h)和H2受体拮抗剂(雷尼替丁,20mg/12h)治疗的同时,还建议在进食前将水和食物垫高,以促进吞咽。
但在接下来的几天里,情况没有任何改善。因此,在之前的治疗基础上增加了抗生素(250 mg阿莫西林+62.5 mg克拉维酸,q12h)、皮质类固醇(15 g泼尼松,q12h)和胃黏膜保护剂(琥珀酸盐,2 mL/12h)。每天还喂食250 g软质食物。
尽管如此,体重仍在不断下降,不仅没有明显改善,反胃现象仍在继续,还发生了吸入性肺炎。由于患者的身体状况很差,主人同意进行胃管喂食。
随后几天的治疗包括雷尼替丁(37.5 mg,q12h)、蔗糖酸钠(2 mL/12h)、甲氧氯普胺(3 mL/12h)、氨苄西林(6 mL/8h)、甲硝唑(6.5 mL/12h)。制定了以牛奶、谷物和Recovery犬粮为基础的软食。动物的情绪和总体状况都有了积极的改善。
然而,反胃现象仍在继续,胃管喂食8天后,平均每天反胃8次,并伴有冷漠和疼痛。因此,主人决定实施安乐死,并同意进行了尸体解剖。
04 尸检
大体检查发现食道明显扩张。食道组织病理学检查显示,食道上皮弥漫性增生,胞浆空泡化,粘膜下层食道腺体数量增加(增生)。主要位于固有层和粘膜下层的淋巴细胞和浆细胞也有轻度多灶性炎症浸润。
食管肌层的肌纤维萎缩(角状萎缩),其横截面轮廓呈轻度至中度角状。正常的肌肉纤维与萎缩的肌肉纤维相邻(下图)。肠肌间神经丛的神经元体出现不同程度的钙化、尼氏体消失和嗜酸性细胞质,其中一些神经元体的细胞核呈脓结状或缺失。在这些变性神经元的周围,发现了由淋巴细胞、巨噬细胞和浆细胞组成的严重炎症浸润。
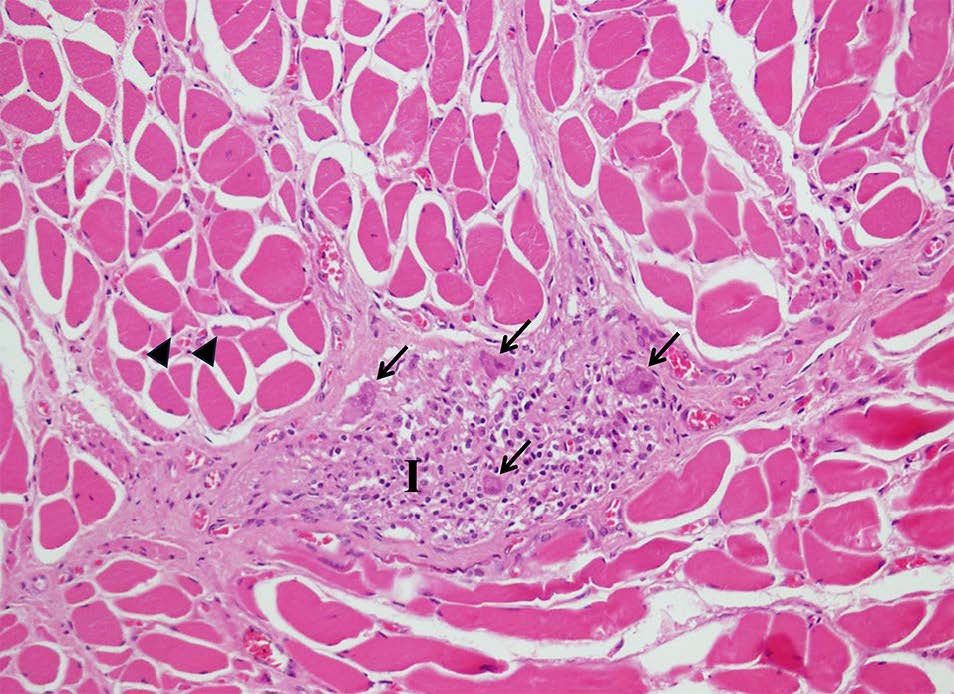
↑ 肠肌间神经丛显示神经元体变性,胞质嗜酸性,细胞核凋亡(箭头),伴有由淋巴细胞、巨噬细胞和浆细胞组成的严重炎症浸润(I)。在肌肉外膜上,观察到一些肌肉纤维出现角状萎缩(三角)。
免疫组化显示,位于炎症浸润中的大部分淋巴细胞是CD3+ T淋巴细胞(下图)。
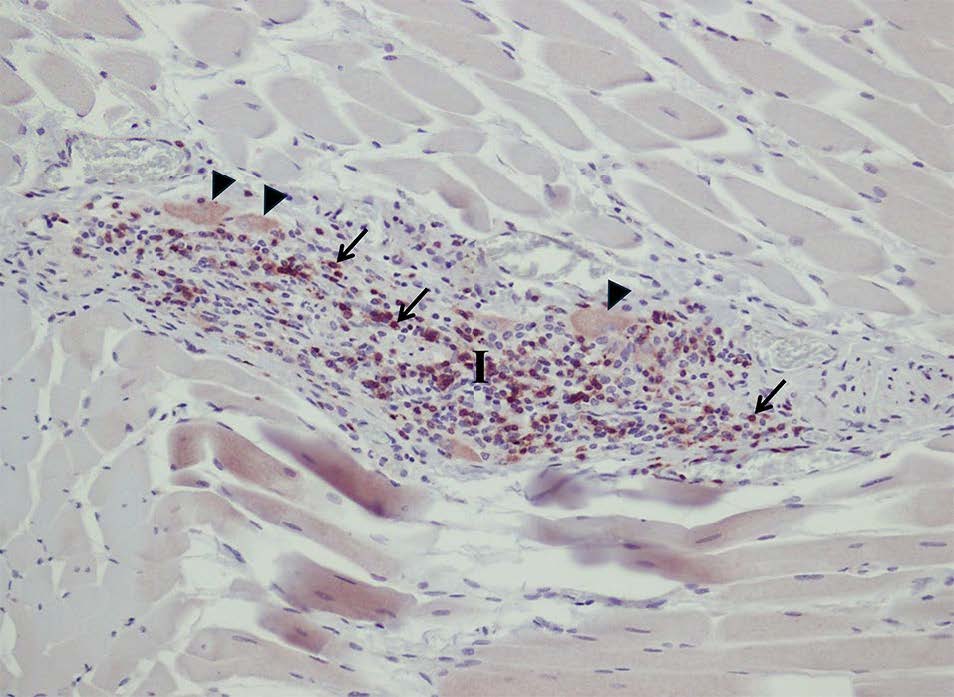
↑ 位于肠肌间神经丛内的CD3+ T淋巴细胞免疫染色呈棕色(箭头),神经元体变性(三角),伴有严重的炎症浸润(I)。
其中一些淋巴细胞显示出强烈的调节性T细胞Foxp3+免疫染色(下图)。
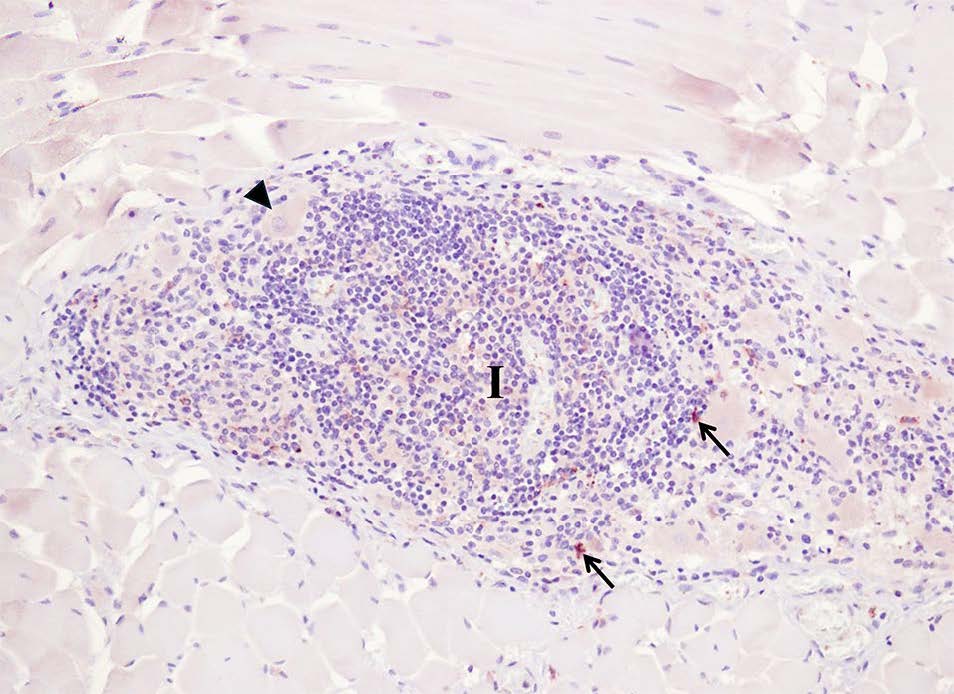
↑ 分离的Foxp3+淋巴细胞(调节性T细胞)呈棕色(箭头),位于肠肌间神经丛,有严重的炎症浸润(I)。
在涉及肠系膜神经的炎症浸润中还观察到表达α-1-抗胰蛋白酶的少量巨噬细胞(下图)。
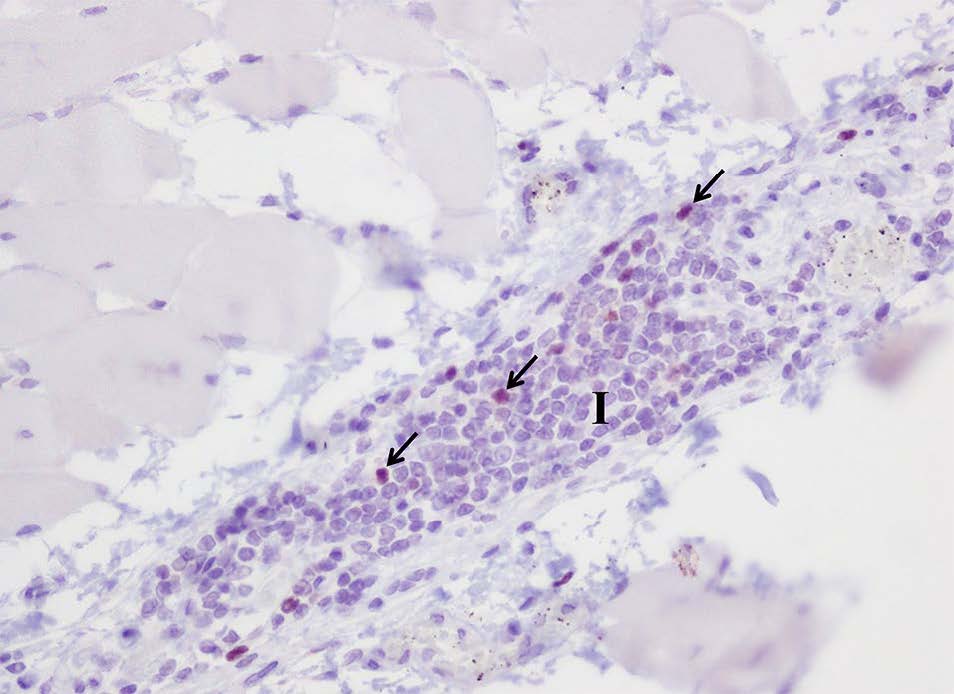
↑ 表达α-1-抗胰蛋白酶的巨噬细胞呈褐色(箭头),位于肠肌间神经丛,神经元体退化(三角)与严重炎症浸润有关(I)。
抗神经丝蛋白抗体有助于检测与炎症浸润相关的神经延长和神经元体残余(下图)。胃和小肠平滑肌未出现组织病理学变化。
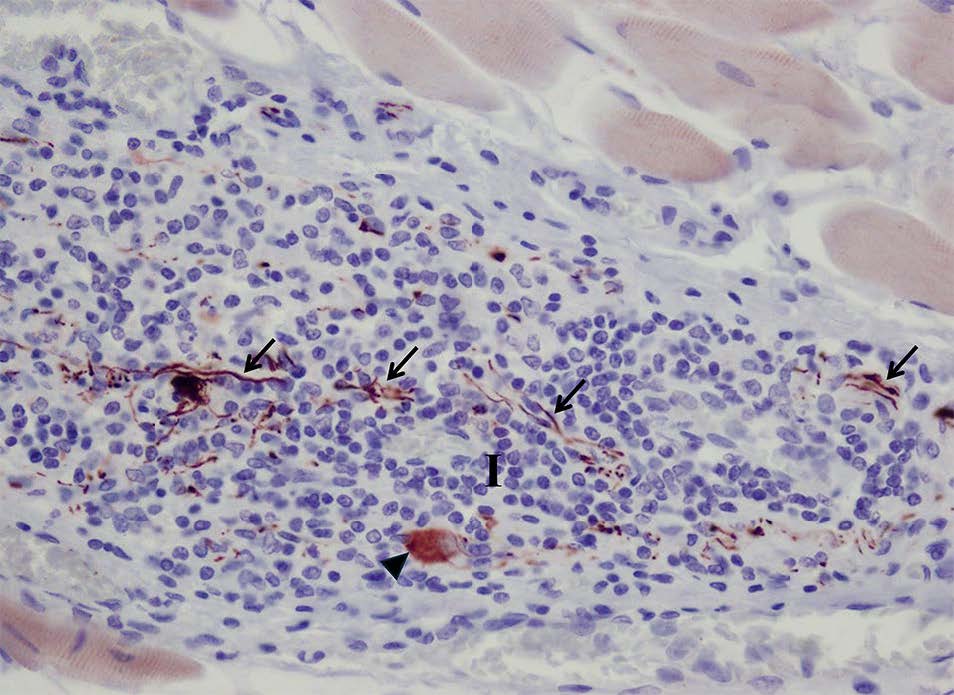
↑ 用抗神经丝蛋白免疫染色的神经延长残留物(箭头)和神经元体(三角),呈棕色,与炎症浸润有关(I)。
05 讨论
巨食管(Megaoesophagus)是一种以食道弥漫性扩张和蠕动减弱为特征的食道疾病,可以是先天性的,也可以是后天性的[1]。巨食管的临床症状包括体重减轻、反胃、呕吐和咳嗽。后天性巨食管可能是特发性的,也可能是许多其他原发性疾病(如神经肌肉、免疫介导、内分泌、胃肠道、副肿瘤和中毒性疾病)的后果[2,3]。
犬后天性巨食管的病因可能与传入神经通路的缺陷有关,这种缺陷会导致对食道胀气的反应减弱[1]。与后天性巨食管相关的最常见神经肌肉疾病包括重症肌无力,这是一种遗传性疾病,会导致神经肌肉接头处的乙酰胆碱受体缺乏或功能异常,患者除巨食管外通常还伴有全身无力[3,4]。重症肌无力还可伴有不同程度的食道、面部、喉或咽部功能障碍[4]。
全身性炎性肌病(如多发性肌炎)和与传染性疾病相关的肌病也会导致巨食管[5,6]。多发性肌炎是一种全身性炎症性肌病,可能源于免疫介导[5]。较少见的与巨食管相关的神经肌肉疾病包括肌肉萎缩症、自律神经失调症、贮积性疾病和神经源性肌肉萎缩症等肌病[5,6]。
在所有后天性犬巨食管病例中,约25%-38%继发于重症肌无力[7,8],但高达42.7%的成年犬巨食管病因不明,这给临床医生实施适当的治疗带来了挑战[8]。这就是为什么50%的成年犬巨食管会发展到死亡或安乐死的原因[8]。
重症肌无力是一种自身免疫性疾病,通过产生针对神经肌肉接头的自身抗体来损害神经肌肉传导[11]。重症肌无力的分类包括局灶性、全身性和急性暴发性三种12,13]。局灶性重症肌无力的定义是一个或多个骨骼肌群无力,但不涉及附属骨骼肌。局灶性骨骼肌群包括面部、食道、咽部和喉部骨骼肌。全身性重症肌无力病程中会出现从轻度到重度的附属骨骼肌无力,伴有或不伴有面部、食道、咽部或喉部骨骼肌受累[4,12-14]。本病例的临床症状与重症肌无力不相符,因为除了食道麻痹外,其他部位没有症状,没有喉部或面部肌肉麻痹、无力或全身乏力。
多发性肌炎和感染性肌病也与犬后天性巨食管有关[5]。但本研究中的这只狗除了食道肌肉外,其他骨骼肌没有出现临床症状或病变,因此排除了这一病因。
自律神经失调症是一种罕见的自律神经疾病,其特征是交感和副交感神经节和神经变性,伴有或不伴有轻微炎症[16]。犬自律神经失调症的临床表现包括胃肠道运动障碍和腹胀、尿潴留、泪液分泌减少或消失、第三眼睑突出和不适当的眼球震颤[16,17]。在本病例中,除了食道蠕动减弱外,没有记录到其他这些症状。此外,肠肌间神经丛中的严重炎症浸润在自律神经失调症犬中并不常见[16]。
在本研究中,与食管肠肌间神经丛相关的炎症浸润主要由CD3+ T淋巴细胞组成,其中存在调节性T淋巴细胞(Foxp3+)。这一发现在人类食道贲门失弛缓症病例中也有描述,该病是一种食道运动障碍,可引起吞咽困难、反胃、胸痛和体重减轻[18]。这种疾病被怀疑是免疫介导的,肠肌间神经丛炎症以及先天性免疫和适应性免疫失衡在病因中起着关键作用[19]。遗憾的是,本病例未检测到自身抗体,因此无法确定巨食管的免疫介导源。
但是,本病例中肠肌间神经丛出现了严重的炎症浸润,这表明在今后的特发性巨食管病例中,应检测自身抗体,以决定是否采用免疫抑制疗法,这种疗法可能可以改善病情。
文献来源:Ruiz-Campillo MT, Herrera-Torres G, Molina-Hernández V, Bautista MJ, Barrero-Torres DM, López-Rasero J, Pérez J. Megaoesophagus associated to inflammatory infiltrate in the autonomous plexus in a 7-year-old Spanish Water Dog. BMC Vet Res. 2024 Nov 29;20(1):534.
参考文献
1. Washabau RJ. Gastrointestinal motility disorders and gastrointestinal prokinetic therapy. Vet Clin North Am Small Anim Pract. 2003;33:1007–28.
2. Marks SL. Disorders of the esophagus. 2017. In: Textbook of Veterinary Internal Medicine 8th ed. (Ettinger, S. J., Feldman, E. C., Côté, E. eds.), Elsevier, St. Louis; 2017. pp. 1481–1490.
3. Mace S, Shelton GD, Eddlestone S, Megaesophagus. Compend Contin Educ Vet. 2012;34:E1.
4. Shelton GD. Myasthenia gravis and disorders of neuromuscular transmission. Vet Clin Small Anim Pract. 2002;32:189–206.
5. Evans J, Levesque D, Shelton GD. Canine inflammatory myophaties: a clinicopathologic review of 200 cases. J Vet Intern Med. 2004;18:679–91.
6. Gabriel A, Poncelet L, Van Ham L, Clercx C, Braund KG, Bhatti S, Detilleux J, Peeters D. Laryngeal paralysis-polyneuropathy complex in young related Pyrenean mountain dogs. J Small Anim Pract. 2006;47:144–9.
7. Washabau R. Canine Idiopathic Megaesophagus: Pathogenesis, Diagnosis, and Therapy. 2001. WSAVA congress, Vancouver 2001.
8. Gomes SA, Van Ham L, Van Ham A, Edward J, Ives MA, Vanhaesebrouck A. Canine nonstructural Megaesophagus as a clinical sign of potential neurological disease: 99 cases. J Am Anim Hosp Assoc. 2020;56:7–16.
9. Molina-Hernández V, Ruiz-Campillo MT, Martínez-Moreno FJ, Buffoni L, Martínez-Moreno A, Zafra R, Bautista MJ, Escamilla A, Pérez-Caballero R, Pérez J. A partially protective vaccine for Fasciola hepatica induced degeneration of adult flukes associated to a severe granulomatous reaction in sheep. Animals. 2021;11:2869.
10. Ruiz-Campillo MT, Molina-Hernández V, Bautista MJ, Pacheco IL, Zafra R, Buffoni L, Martínez-Moreno FJ, Martínez-Moreno A, Pérez J. Characterization of dendritic cells and follicular dendritic cells in the hepatic lymph nodes and liver of sheep experimentally infected with Fasciola hepatica. Vet Res. 2020;51:33.
11. Shelton GD. Myasthenia gravis and congenital myasthenic syndromes in dogs and cats: a history and mini-review. Neuromuscul Disord. 2016;26:331–4.
12. Dewey CW, Bailey CS, Shelton GD, Kass PH, Cardinet GH III. Clinical forms of acquired myasthenia gravis in dogs: 25 cases (1988–1995). J Vet Intern Med. 1997;11:50–7.
13. DucotéJM, Dewey CW, Coates JR. Clinical forms of acquired myasthenia gravis in cats. Compend Contin Educ Pract Vet. 1999;21:440–8.
14. Dickinson PJ, LeCouteur RA. Feline neuromuscular disorder. Vet Clin North Am Small Anim Pract. 2004;34:1307–59.
15. Detweiller DA, Biller DS, Hoskinson JJ, Harking KR. Radiographic findings of canine dysautonomia in twenty-four dogs. Vet Radiol Ultrasound. 2001;42:108–12.
16. O’Brien DP, Johnson GC. Dysautonomia and autonomic neuropathies. Vet Clin North Am Small Anim Pract. 2002;32:251–65.
17. Clarke KE, Sorrell S, Breheny C, Jepson R, Adamantos S, Milne EM, Gunn-Moore D. Dysautonomia in 53 cats and dogs: retrospective review of clinical data and outcome. Vet Rec. 2020;187:e118.
18. Wu XY, Liu ZQ, Wang Y, Chen WF, Gao PT, Li QL, Zhou PH. The etiology of achalasia: an immune-dominant disease. J Dig Dis. 2021;22(3):126–35.19. Yao L, Liu Z, Chen W, Xu J, Xu X, Xu J, Ma L, Li X, Li Q, Zhou P. Imbalance of innate and adaptive immunity in esophageal achalasia. J Neurogastroenterol Motil. 2023;29(4):486–500.