
| 品种:德国牧羊犬 | |
| 年龄:3岁 | |
| 性别:雌 | |
| 诊断:干燥综合征 | |
01 主诉及病史
双眼结膜充血和粘液性分泌物3个月。
有特应性皮炎病史(病程3个月),自领养以来曾间歇性出现抗生素反应性发烧和双耳感染。主人近期没有报告过病毒感染病史,包括COVID-19。
3个月前,因双眼结膜充血就诊。Schirmer泪液测试1(STT1)结果为双眼0 mm/min。开始使用局部润滑剂治疗,左眼使用氧氟沙星滴眼液和环孢素眼膏(因怀疑浅表性溃疡性角膜炎),8小时一次。兽医皮肤科医生证实了特应性皮炎,建议每4-6周进行一次皮下Cytopoint注射,同时根据皮内皮肤测试结果,每隔一周进行一次皮下过敏原注射。
2个月前,因严重的双眼眼睑痉挛和粘液性分泌物就诊。STT1结果为双眼0 mm/min。建议每12小时使用一次他克莫司滴眼液,每24小时使用一次新霉素-多粘菌素-地塞米松眼膏,并尽可能频繁地使用Optixcare眼用润滑剂。医生给予了阿托品溶液口服,以确定是否可以进行腮腺导管转位术。由于阿托品味苦,口服阿托品通常会立即导致大量流涎,但该患者未出现唾液分泌,预后不佳。随后转诊治疗。
02 检查
体重33.4千克。神志清醒、警觉、反应灵敏。下颌唾液腺和下颌下淋巴结触诊均无异常。
轻度至中度眼睑痉挛。眼周可见粘稠、多为结痂的粘液性分泌物。神经眼科检查,包括光照条件下的视觉功能均正常。
结膜和眼前节检查发现有双眼轻度弥漫性结膜充血,双眼角膜前泪膜无光泽,左眼角膜上皮下到前基质轻度轴性混浊(直径约3 mm),以及双眼浆液性核白内障(下图)。
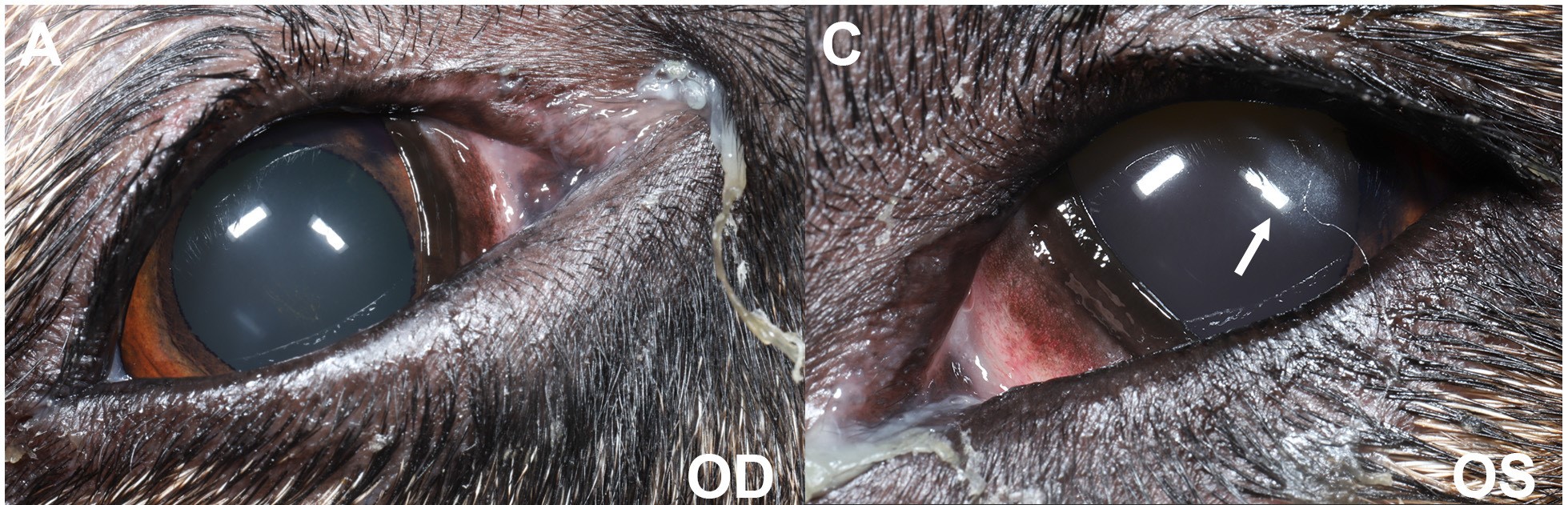
↑ 初次评估时的临床照片。(AC)眼睑痉挛表现为眼外眦睑裂开口缩小(左眼>右眼)。外侧内眦出现轻度至中度粘液性分泌物。第三眼睑前表面有弥漫性结膜充血。角膜轴向至颞侧旁可见直径约3 mm的上皮下卵圆形浅层角膜混浊灶(白色箭头)。
STT1为双眼0 mm/min,眼压为右眼14 mmHg,左眼13 mmHg。两个鼻孔湿润。角膜荧光素染色显示轻度、弥漫性多灶性点状染色,符合角膜干燥,但没有上皮脱落。
按照之前的处方,继续使用局部他克莫司滴眼液和新霉素-多粘菌素-地塞米松眼膏。还添加了毛果芸香碱滴眼液(双眼,q8h)和透明质酸滴眼液(双眼,q4-6h)。
1个月后,主人说出现了眯眼(左眼比右眼严重),双眼发红。2周前颈部出现了两个大肿块,兽医进行了活检,但没有得出结论。开始使用多西环素(12 mg/kg PO q24h),但未见任何改善。由于眼部刺激,毛果芸香碱已停用。
检查发现STT1仍为双眼0 mm/min。眼科检查结果与初次检查相似,但发现了新的弥漫性轴状上皮下至前部白色结晶基质不透明,符合双眼类固醇性角膜病的脂质沉积。口服阿托品后没有流涎。
颈部触诊发现双侧下颌唾液腺肿大(左侧比右侧大)。包括外周淋巴结触诊无异常。两个月前的血检结果显示白细胞增多,中性粒细胞增多(19 K/uL [2.94-12.67]),轻度低钾血症(3.8 mmol/L [4.0-5.4]),尿检正常,甲状腺功能正常(2.0μg/dL [1.0-4.0])。
考虑到眼部疾病的难治性,增加了他克莫司的浓度和次数,每8小时一次注射异源犬血清以缓解眼部不适,晚上使用眼膏,将毛果芸香碱滴入食物中。综合所有检查结果,考虑腮腺导管转位术的预后较差。
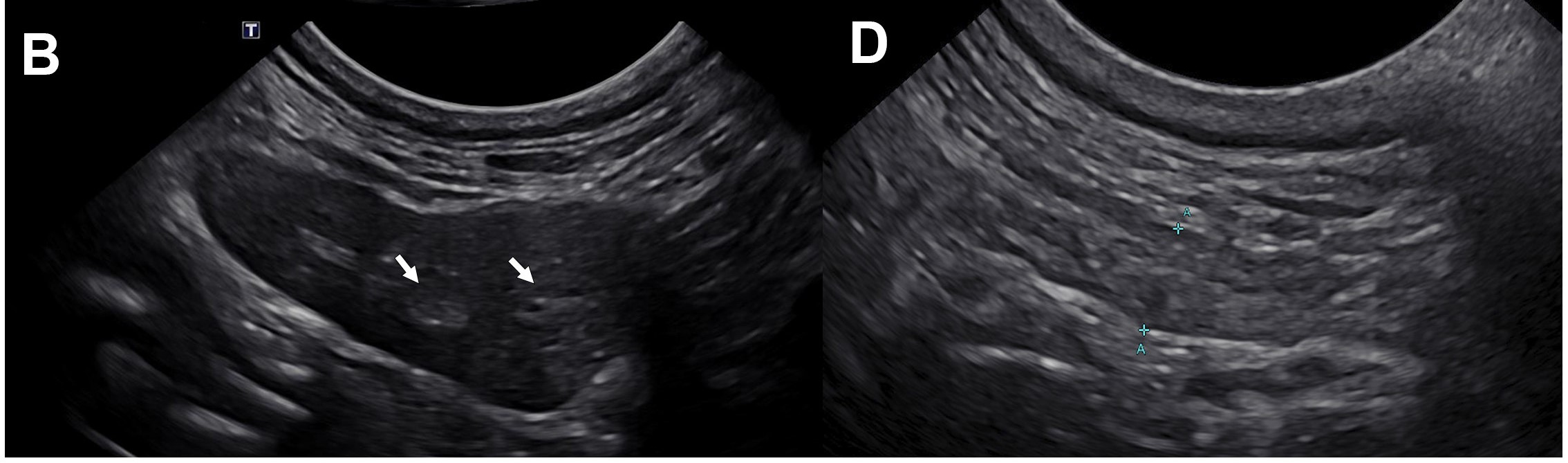
胸部放射线和腹部超声均无异常。腮腺和下颌唾液腺超声显示,下颌唾液腺和腮腺发生声像图变化,并伴有区域性淋巴结肿大(下图)。双下颌唾液腺中度肿大(高2.5 cm),呈低回声,伴有细微的低回声。双侧唾液腺内有一些小的高回声病灶,但没有明显的远端声影。下颌唾液腺周围脂肪呈低回声。双侧腮腺呈轻度低回声,伴有细微的低回声斑点。双侧腮腺高度约0.5 cm。咽后内侧、下颌和腮腺淋巴结双侧呈轻度圆形,包膜内低回声区不清晰。淋巴结正常或轻微肿大,右下颌外侧淋巴结最大(约0.55 cm)。甲状腺正常。
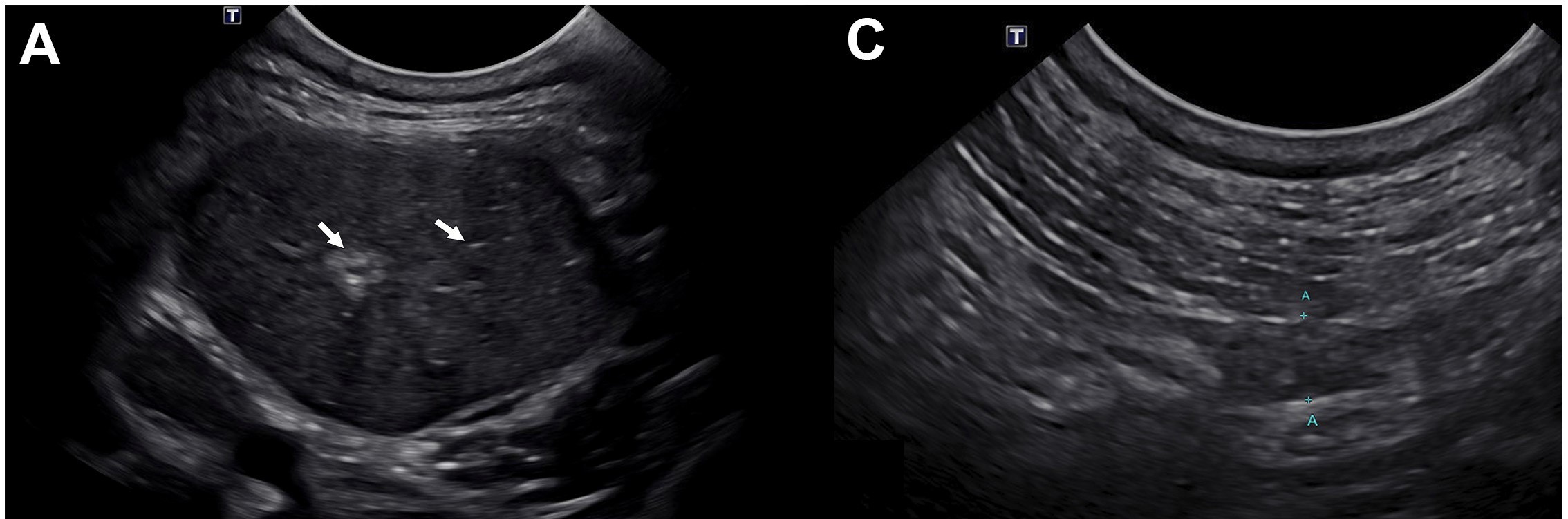
↑ 左下颌唾液腺和左腮腺超声图像。(A)双下颌唾液腺中度肿大(仅左侧显示),呈低回声,伴有细微的低回声斑,唾液腺周围的脂肪呈轻度高回声。实质呈微弱异质(白色箭头)。左下颌唾液腺高度约2.5 cm。(C)左腮腺轻度回声改变,实质区少量低回声。左腮腺高度约0.5 cm。
活体共聚焦显微镜和光谱域光学相干断层扫描(SD-OCT)显示,双侧轴向角膜上皮下到基质角膜高反射沉积物符合继发于局部类固醇的脂质。抗核抗体(ANA)滴度为1:160,呈阳性。
下颌唾液腺活检显示,约60%的唾液腺切片被炎性细胞严重浸润,主要是淋巴细胞和组织细胞,这些细胞取代并侵蚀了腺体结构(下图)。淋巴细胞有汇合灶,病灶评分为12分。在人体中,原发性干燥综合征的组织学诊断主要依赖于观察到至少一个病灶,即在4平方毫米的腺组织内,围绕血管或导管的≥50个单核细胞聚集(病灶评分≥1)。没有肿瘤(淋巴瘤)或感染性病原体的证据。
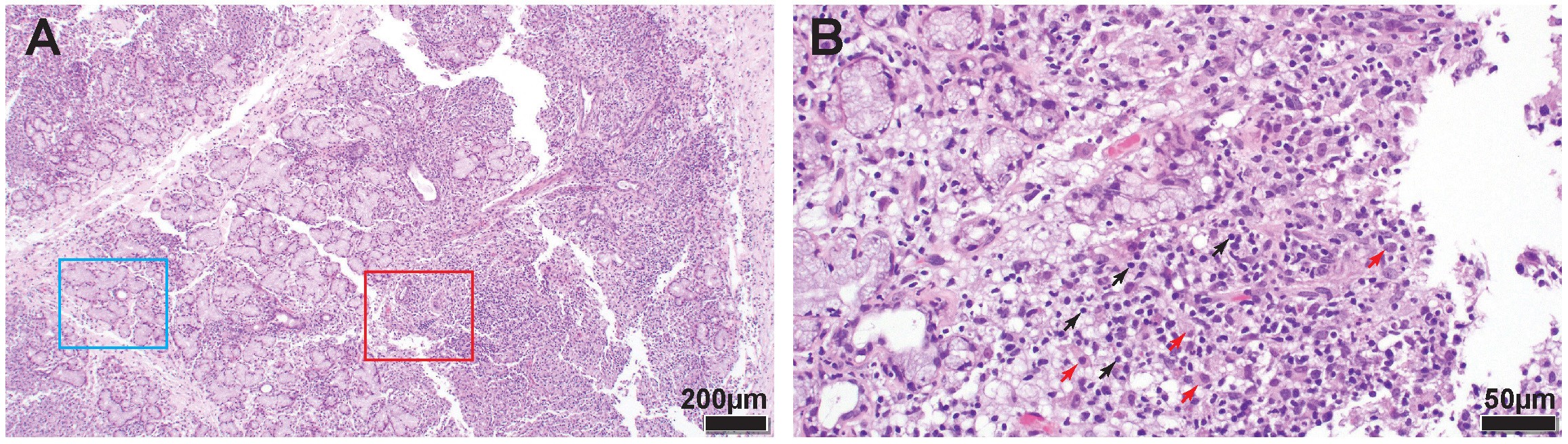
↑ (A)正常的管状腺体结构仍然存在(蓝色矩形),约60%的切片被炎症细胞严重浸润,取代并侵蚀了腺体结构(红色矩形)。(B)放大后可看到炎症浸润中主要是小淋巴细胞(黑色箭头)和组织细胞(红色箭头)。
CD3和CD204的免疫组化分析表明,细胞浸润由T细胞和巨噬细胞组成,两者比例为50:50(下图)。
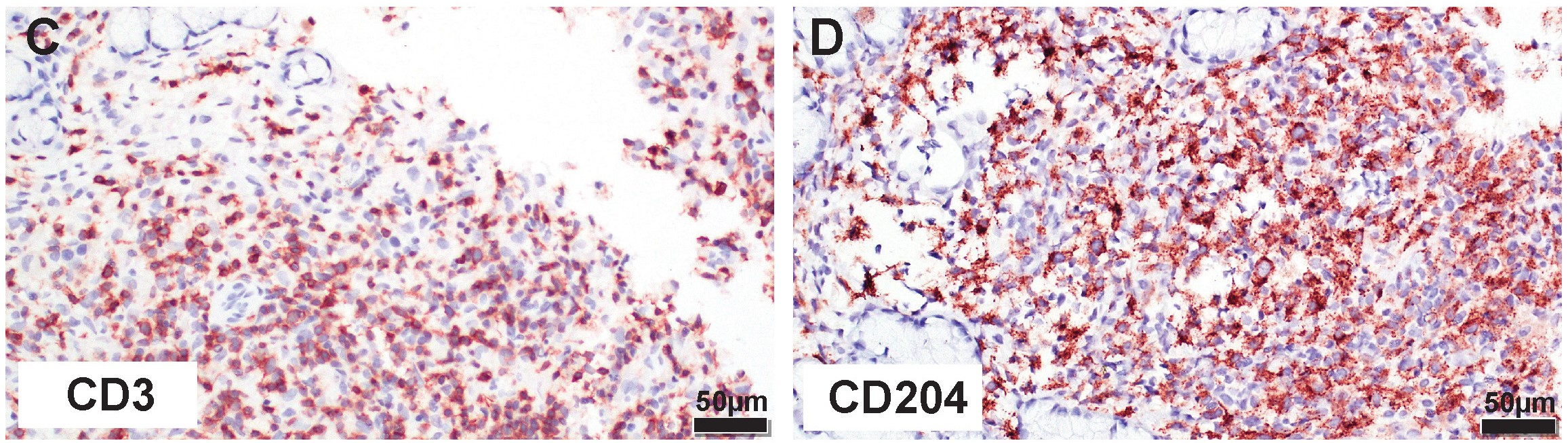
↑ (C)CD3免疫组化可见约50%的炎性浸润对CD3(T细胞)有免疫反应。(D)CD204免疫组化检测可见约50%的炎症浸润对CD204(巨噬细胞)有免疫反应。
CD20和CD79a的免疫组化显示,罕见的单个B细胞随机散布在整个唾液腺切片中(下图)。
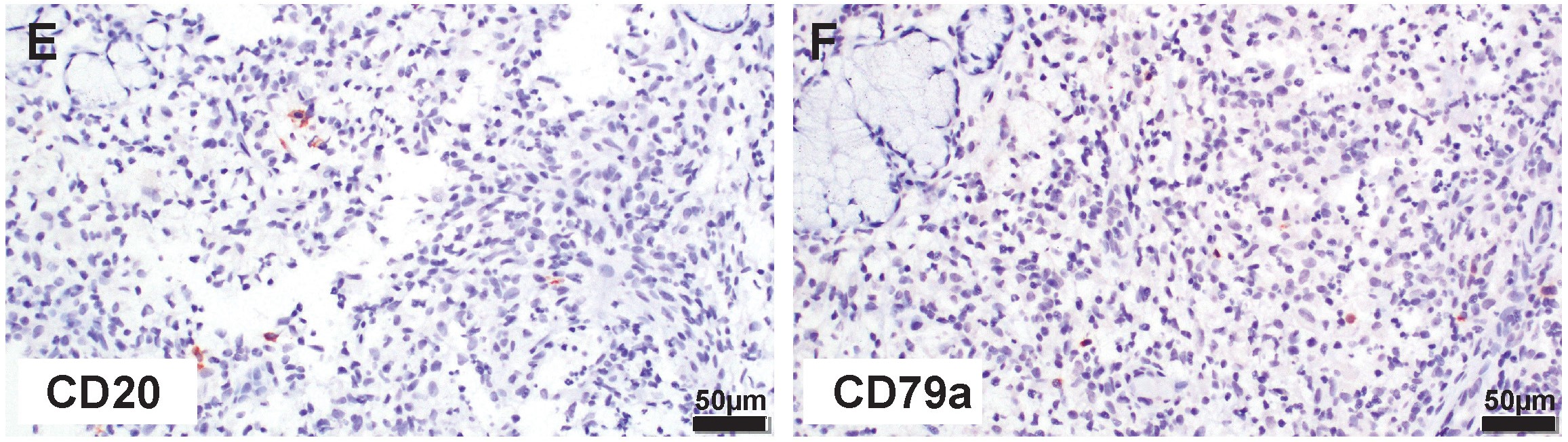
↑ (E)CD20免疫组化检测可见切片中散布的罕见免疫活性B细胞。(F)CD79a免疫组化检测可见切片中散布的罕见免疫反应性B细胞。
鉴于人类原发性干燥综合征病例中的炎症浸润以CD4+ T细胞为主,因此进行了实时定量PCR。将犬唾液腺活检结果(27.04)与正常犬下颌淋巴结组织(27.39)的qRT-PCR结果(Cq值)进行比较。由于正常唾液腺中的常驻淋巴细胞极少甚至没有,这一结果表明唾液腺中CD4淋巴细胞的比例极高。
03 治疗
由于缺乏临床反应,停用毛果芸香碱,开始口服泼尼松(1.3 mg/kg/天)。
04 预后
1个月后,情况明显好转,唾液腺肿胀消退。眼睑痉挛缓解,结膜充血和分泌物残留极少。鉴于对口服泼尼松的反应良好,开始减少剂量,并开始口服来氟米特(2 mg/kg/天)进行长期治疗。
2个月后,眼睛能够睁开,双眼有轻微分泌物。来氟米特的活性代谢产物特立氟胺的血清浓度为25.1μg/mL,在预期范围(25-45)内。尽管眼部舒适度明显改善,但STT1测量结果仍为双眼0 mm/min。但口服阿托品后出现了积极反应,表明唾液分泌恢复了(下图)。
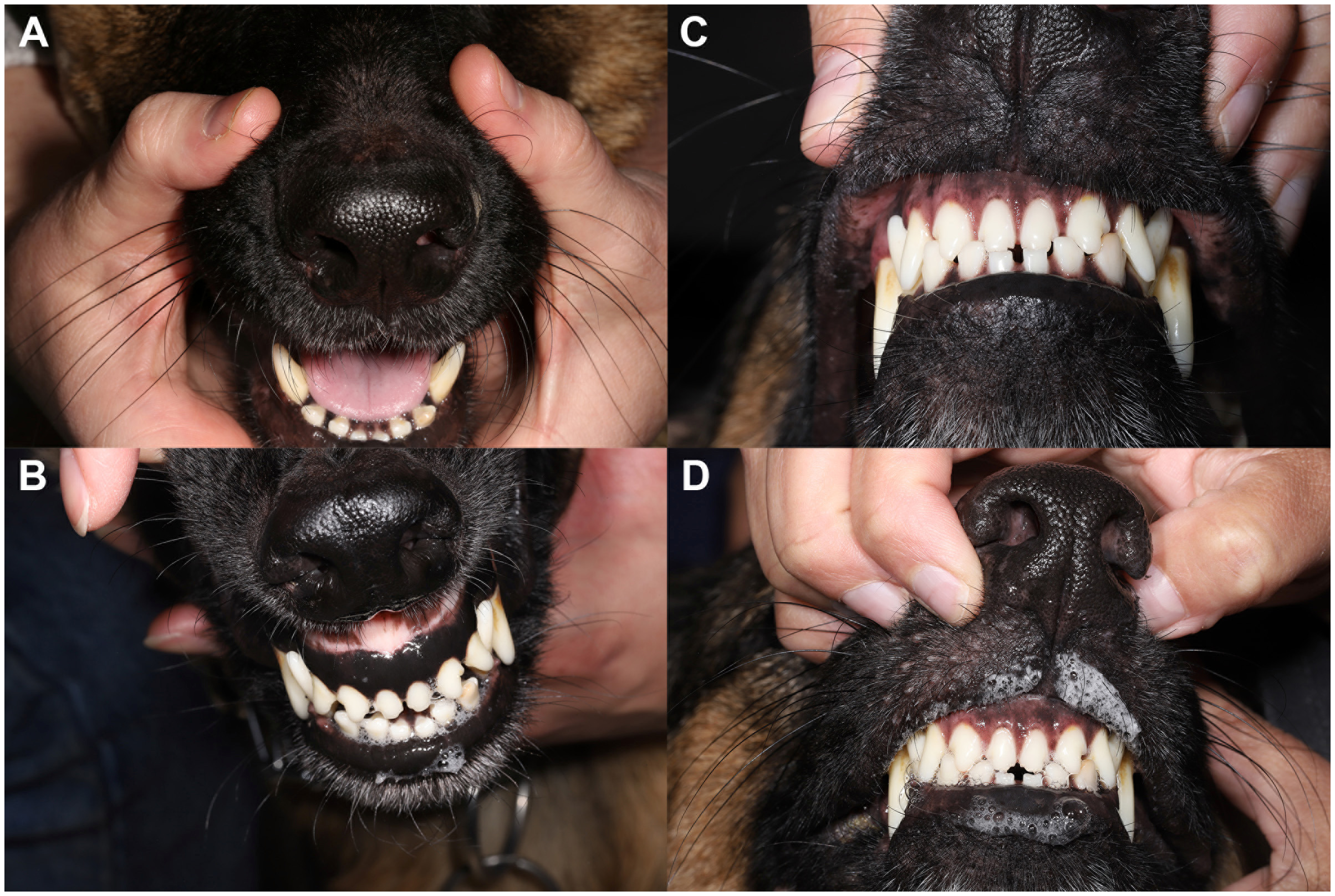
↑ 阿托品口服反应试验显示,在开始口服消炎药后,情况明显好转。(A)在口服消炎药之前,每次口服1%阿托品溶液,口干仍持续存在。(B)口服消炎药1个月后,阿托品反应正常,恢复了轻度至中度流涎。口服消炎药6个月后的阿托品口服反应测试前(C)和测试后(D)。所有照片中的鼻腔均保持湿润。
3个月后,唾液腺超声显示,下颌唾液腺和腮腺大小正常,实质轻度重塑,没有观察到活动性炎症的迹象(下图)。
↑ 左下颌唾液腺和左腮腺超声图像。(B)口服抗炎药治疗3个月后,双下颌唾液腺(仅左侧显示)的大小均正常。实质仍然存在轻微异质性,整个组织中存在少量高回声区和斑点(白色箭头)。唾液腺周围组织处于静止状态,没有活动性炎症的证据。左下颌唾液腺高度为1.2 cm。(D)口服抗炎药治疗3个月后,左腮腺回声轻度改善。左腮腺高度约0.45 cm。与下颌唾液腺相比,腮腺的变化不太明显。
6个月后,眼睛能够睁大,感觉舒适,眼分泌物也很少(下图)。
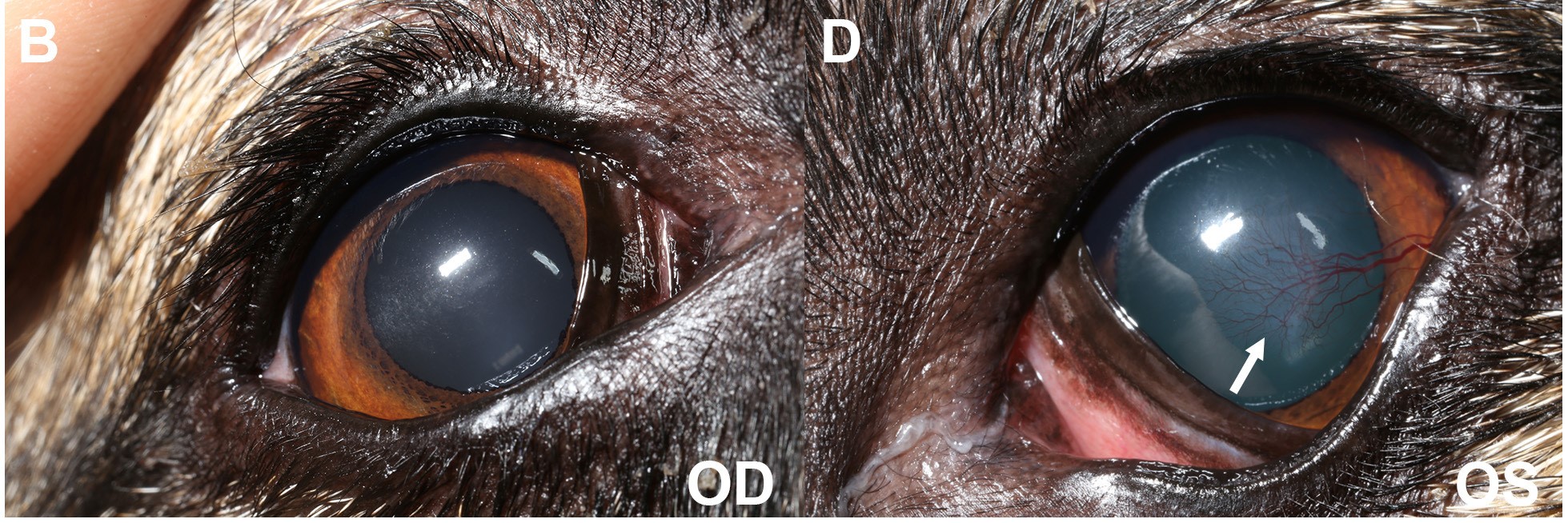
↑ 口服消炎药治疗6个月后。(BD)眼睑痉挛消失。眼内侧有轻度粘液分泌物。结膜充血情况有所改善。轻度的轴向(右眼)和颞旁(左眼)角膜纤维化仍然存在,左眼的密度有所改善,角膜表层出现了新生血管(白色箭头)。
05 讨论
在兽医学中,对干燥综合征(Sjogren’s disease,SD)的发病存在争议。在人类中,SD是一种常见的全身性自身免疫性疾病,女性发病率为0.5%[1]。这种疾病常分为原发性或继发性。当SD伴有系统性红斑狼疮、系统性硬化或类风湿性关节炎时,被称为继发性SD,而原发性SD发生时无继发性组织病变。但最近有人提出要统一SD的定义[2]。
SD的诊断是根据美欧共识小组制定的多项标准做出的,进一步的验证和诊断标准正在制定中,而关于原发性SD诊断标准的明确共识还存在争议[3,4]。体格检查发现的角膜结膜炎、口干和ANA抗体的存在通常支持SD的诊断。
组织病理学发现,原发性SD患者的唾液腺中淋巴单核细胞浸润聚集成导管周围浸润,这是一个标志性发现[5]。这种疾病可影响多个分泌腺,导致发热、肺部疾病、唾液腺肿大以及胃肠道、皮肤、肾脏、牙科、风湿、神经和妇科疾病[6]。
此前曾有报道称,两只群居犬(5岁和7岁的雌性迷你贵宾犬)出现角膜结膜炎和口干,组织病理学和ANA滴度均提示SD[7]。也有报道称,家养短毛猫和金毛寻回犬也患有类似SD的疾病[8,9]。然而,这两份报告中都没有ANA滴度呈阳性的病例,而且狗也没有干眼症的迹象。
本研究记录了一只3岁已绝育雌性德国牧羊犬疑似SD的临床、超声、组织学和免疫组化结果。通过STT1结果和眼部临床症状确诊为干眼症。口服阿托品反应试验后,唾液分泌不足,从而获得了口腔干燥的证据。唾液腺炎症的免疫介导病因是通过组织学、免疫组化、分子检测和ANA滴度阳性来确定的。唾液腺超声进一步确定了疾病过程和治疗反应。最后,患者对免疫抑制治疗的良好反应再次证实了SD诊断,干眼和口干症状均得到明显改善。
人类SD的治疗通常需要使用糖皮质激素,尤其是用于治疗腺体肿大[25]。在本病例中,外用血清、外用免疫抑制剂和前列腺素(环孢素和他克莫司)、口服或外用毛果芸香碱均未获得眼部反应。在口服消炎药之前,眼用润滑剂也无法改善眼部舒适度。
选择糖皮质激素是因为其起效迅速,而且观察到了显著的改善。由于长期口服泼尼松会产生副作用,因此又增加了来氟米特作为维持治疗药物,因为这种药物对狗来说通常是安全的,长期服用也能很好地耐受,而且还能进行治疗药物监测[26]。
尽管眼部舒适度有了显著改善,但双眼STT1的值仍为0 mm/min。推测这是由于慢性病程导致泪腺明显破坏和/或萎缩,而患者舒适度的改善则归功于口服药物的抗炎作用。同样,在一个已报道的猫病例中,药物免疫抑制也未能缓解干眼症[9]。
泼尼松诱导治疗和硫唑嘌呤维持治疗可改善一只金毛寻回犬类似SD的临床症状[8]。鉴于在口服阿托品并进行免疫抑制后观察到唾液腺肿大和唾液分泌有所缓解,如果该患者的干眼症状恶化,可以考虑使用局部滴眼液疗法。
总之,在动物中很少发现SD。头颈部超声和组织病理学检查以及病灶评分是确诊SD的重要诊断方法。免疫组织化学可进一步帮助诊断和确定犬SD的特征。泪液分泌可能无法通过治疗得到改善,尤其是慢性疾病。口服抗炎糖皮质激素在改善眼部舒适度、腺体增大和口腔干燥方面起着关键作用。长期使用来氟米特进行免疫抑制可使上述症状得到维持。
对于双侧下颌唾液腺肿大、口干和双侧角膜结膜炎且ANA滴度呈阳性的动物,应考虑诊断为SD。腺体活检的免疫组化检查可发现T细胞和巨噬细胞浸润。对疑似SD患者进行进一步的组织病理学研究可能有助于阐明犬SD的发病机制,并有助于预防、诊断和治疗这种罕见的疾病。
文献来源:Story BD, Thomasy SM, Randolph MW, Vincek A, Martins B, Mills EP, Dear JD, Johnson EG, Jordan RC, Goldschmidt SL and Vapniarsky N (2024) Case report: Clinical and immunohistochemical manifestations of suspected Sjogren’s disease in a dog. Front. Vet. Sci. 11:1479363.
参考文献
1. Pillemer SR, Matteson EL, Jacobsson LT, Martens PB, Melton LJ, O’Fallon WM, et al. Incidence of physician-diagnosed primary Sjogren syndrome in residents of Olmsted County, Minnesota. Mayo Clin Proc. (2001) 76:593–9.
2. Kollert F, Fisher BA. Equal rights in autoimmunity: is Sjogren’s syndrome ever ‘secondary’? Rheumatology (Oxford). (2020) 59:1218–25.
3. Vitali C, Bombardieri S, Jonsson R, Moutsopoulos HM, Alexander EL, Carsons SE, et al. Classification criteria for Sjogren’s syndrome: a revised version of the European criteria proposed by the American-European Consensus Group. Ann Rheum Dis. (2002) 61:554–8.
4. Shiboski CH, Shiboski SC, Seror R, Criswell LA, Labetoulle M, Lietman TM, et al. 2016 American College of Rheumatology/European league against rheumatism classification criteria for primary Sjogren’s syndrome: a consensus and data-driven methodology involving three international patient cohorts. Arthritis Rheumatol. (2017) 69:35–45.
5. Kroese FGM, Haacke EA, Bombardieri M. The role of salivary gland histopathology in primary Sjogren’s syndrome: promises and pitfalls. Clin Exp Rheumatol. (2018) 36:222–33.
6. Bell M, Askari A, Bookman A, Frydrych S, Lamont J, McComb J, et al. Sjogren’s syndrome: a critical review of clinical management. J Rheumatol. (1999) 26:2051–61.
7. Quimby FW, Schwartz RS, Poskitt T, Lewis RM. A disorder of dogs resembling Sjogren’s syndrome. Clin Immunol Immunopathol. (1979) 12:471–6.
8. Nabeta R, Kambe N, Nakagawa Y, Chiba S, Xiantao H, Furuya T, et al. Sjogren’s-like syndrome in a dog. J Vet Med Sci. (2019) 81:886–9.
9. Canapp SOJr, Cohn LA, Maggs DJ, Miller MA, Kerl ME, O’Brien DP. Xerostomia, xerophthalmia, and plasmacytic infiltrates of the salivary glands (Sjogren’s-like syndrome) in a cat. J Am Vet Med Assoc. (2001) 218:59–65.
10. Ma IH, Chen LW, Tu WH, Lu CJ, Huang CJ, Chen WL. Serum components and clinical efficacies of autologous serum eye drops in dry eye patients with active and inactive Sjogren syndrome. Taiwan J Ophthalmol. (2017) 7:213–20.
11. Verstappen GM, Kroese FGM, Bootsma H. T cells in primary Sjogren’s syndrome: targets for early intervention. Rheumatology. (2021) 60:3088–98.
12. Fox RI. Sjogren’s syndrome. Lancet. (2005) 366:321–31.
13. Veenbergen S, Kozmar A, van Daele PLA, Schreurs MWJ. Autoantibodies in Sjogren’s syndrome and its classification criteria. J Transl Autoimmun. (2022) 5:100138.
14. Neumann M, Quintero J, Shih T, Capitle EM. Not all Sicca is Sjogren’s and not all Sjogren’s is Sicca. Cureus. (2021) 13:e12996.
15. Fox RI, Adamson TC, Fong S, Young C, Howell FV. Characterization of the phenotype and function of lymphocytes infiltrating the salivary gland in patients with primary Sjogren syndrome. Diagn Immunol. (1983) 1:233–9.
16. Zhou D, McNamara NA. Macrophages: important players in primary Sjogren’s syndrome? Expert Rev Clin Immunol. (2014) 10:513–20.
17. Zhou D, Chen YT, Chen F, Gallup M, Vijmasi T, Bahrami AF, et al. Critical involvement of macrophage infiltration in the development of Sjogren’s syndrome-associated dry eye. Am J Pathol. (2012) 181:753–60.
18. Zeher M, Adany R, Nagy G, Gomez R, Szegedi G. Macrophage containing factor XIII subunit a in salivary glands of patients with Sjogren’s syndrome. J Investig Allergol Clin Immunol. (1991) 1:261–5.
19. Tominaga M, Migita K, Sano H, Fukui W, Kohno M, Tsubouchi Y, et al. Expression of cyclooxygenase-1 (COX-1) in labial salivary glands of Sjogren’s syndrome. Clin Exp Immunol. (2000) 122:459–63.
20. Christodoulou MI, Kapsogeorgou EK, Moutsopoulos HM. Characteristics of the minor salivary gland infiltrates in Sjogren’s syndrome. J Autoimmun. (2010) 34:400–7.
21. Manoussakis MN, Boiu S, Korkolopoulou P, Kapsogeorgou EK, Kavantzas N, Ziakas P, et al. Rates of infiltration by macrophages and dendritic cells and expression of interleukin-18 and interleukin-12 in the chronic inflammatory lesions of Sjogren’s syndrome: correlation with certain features of immune hyperactivity and factors associated with high risk of lymphoma development. Arthritis Rheum. (2007) 56:3977–88.
22. Singh AG, Singh S, Matteson EL. Rate, risk factors and causes of mortality in patients with Sjogren’s syndrome: a systematic review and meta-analysis of cohort studies. Rheumatology. (2016) 55:450–60.
23. Du W, Han M, Zhu X, Xiao F, Huang E, Che N, et al. The multiple roles of B cells in the pathogenesis of Sjogren’s sydrome. Front Immunol. (2021) 12:684999.
24. Segerberg-Konttinen M, Konttinen YT, Bergroth V. Focus score in the diagnosis of Sjogren’s syndrome. Scand J Rheumatol Suppl. (1986) 61:47–51.
25. Saraux A, Pers JO, Devauchelle-Pensec V. Treatment of primary Sjogren syndrome. Nat Rev Rheumatol. (2016) 12:456–71.26. Chesne RB, Doornink MT, Sri-Jayantha LSH, Urie BK. Leflunomide with prednisone or nonsteroidal anti-inflammatory drug therapy is safe and tolerated for long-term treatment of immune-mediated polyarthritis in 27 dogs. J Am Vet Med Assoc. (2024) 1:1–5.