
| 品种:伯曼猫 | |
| 年龄:5岁 | |
| 性别:雌 | |
| 诊断:无绿藻病 | |
01 主诉及病史
因右眼葡萄膜炎1.5个月的病史被转诊到本院。
02 检查
神经眼科评估显示,右眼失明,有严重的葡萄膜炎症状,左眼未受影响。
超声显示右眼渗出性视网膜脱离,证实为不可逆转的失明。
5.5个月后,左眼也出现了葡萄膜炎的症状(下图)。
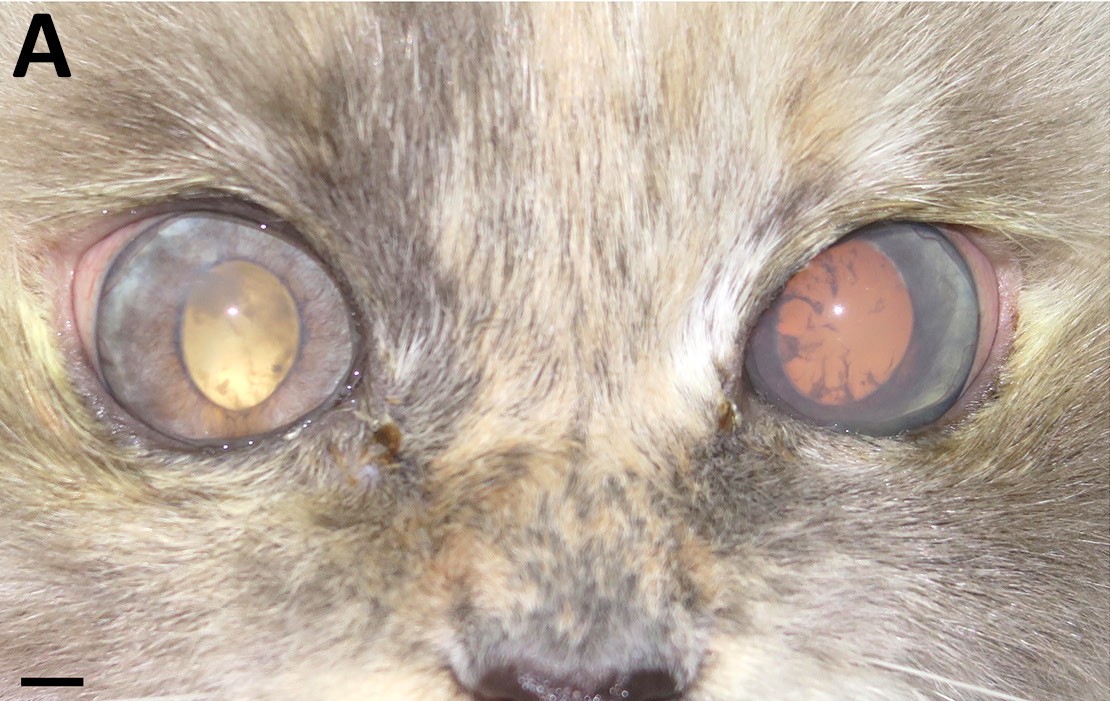
↑ 初次就诊后5.5个月,显示双眼葡萄膜炎。
6.5个月后,左眼房水闪光恶化(下图)。
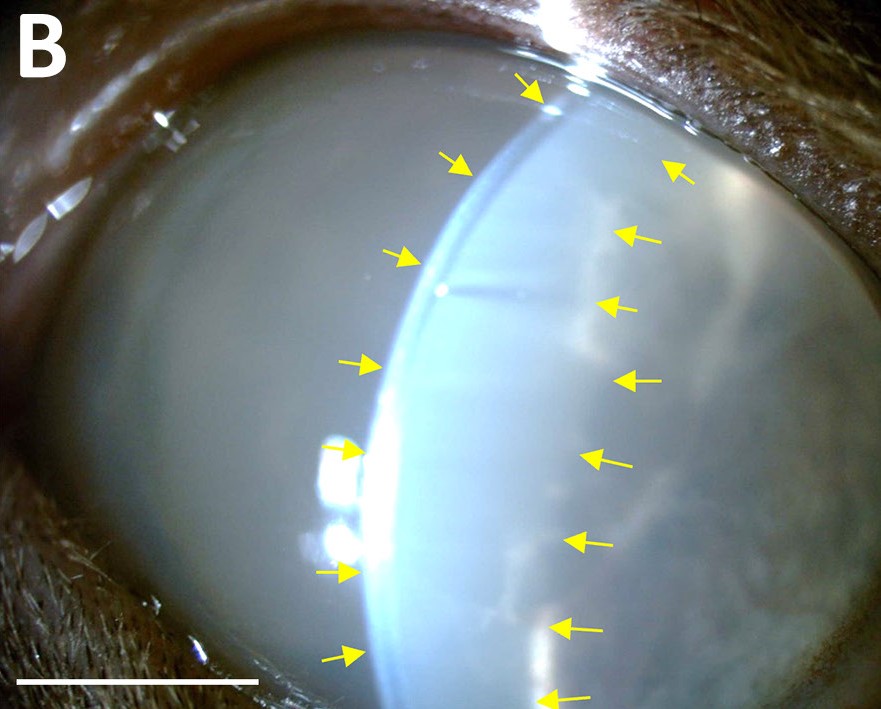
↑ 左眼裂隙灯生物显微镜图像,显示在初次就诊后6.5个月出现明显房水闪光(黄色箭头)。
获得了房水样本和玻璃体样本进行细胞学检查,结果显示混合炎症过程,玻璃体中存在与无绿藻形态相似的结构(下图)。
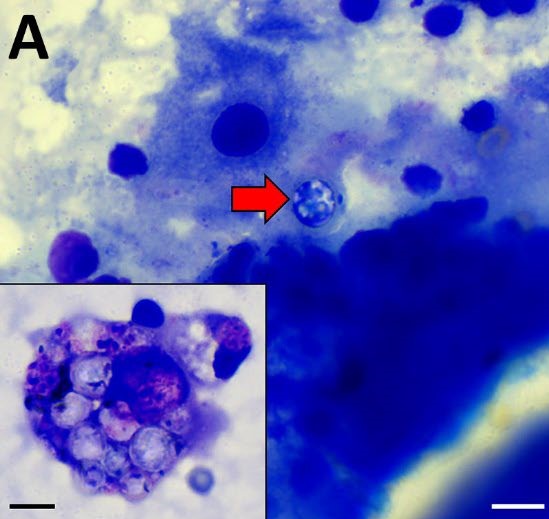
↑ 玻璃体穿刺样本染色显示,存在大量直径为5-6 μm的圆形微生物,具有薄囊,与无绿藻类相似(红色箭头)。插图显示巨噬细胞吞噬了大约10个微生物。
03 治疗
10.5个月后,开始伊曲康唑(5 mg/kg BID)的抗真菌治疗,在14.5个月时由主人主动停药。
04 预后
16.5个月后,完全失明,临床症状随着角膜沉积物的发展而恶化(下图)。
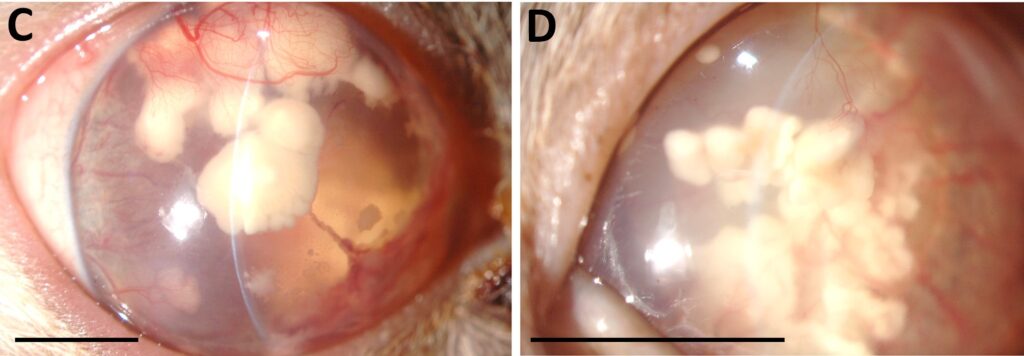
↑ 在16.5个月时,通过裂隙灯生物显微镜检查对右眼(C)和左眼(D)进行成像,发现角膜内皮大量沉积物来源不明,推测是无绿藻入侵的结果。
17.5个月时,观察到2次神经症状,包括前庭症状、共济失调和定向障碍。
19.5个月时,失去了听力。
21.5个月时,神经状态进一步恶化,出现癫痫发作和长期厌食。主人选择了安乐死,没有进行全身尸检。
05 病理结果
眼球被送去做活组织检查。在固定和自溶发生之前,样本已经冷冻,因此由于伪影,组织病理学诊断具有挑战性。
在所有眼部结构中都可以看到弥漫性渗出物(下图B)。观察到轴状角膜内的核碎裂残留物和微生物(下图C)。晶状体囊破裂,晶状体内存在微生物和过成熟白内障形成(下图D)。微生物表现出明显的PAS阳性和阿尔新蓝阴性膜。隐球菌的PCR结果为阴性,根据形态学和染色特征,怀疑诊断为无绿藻感染。
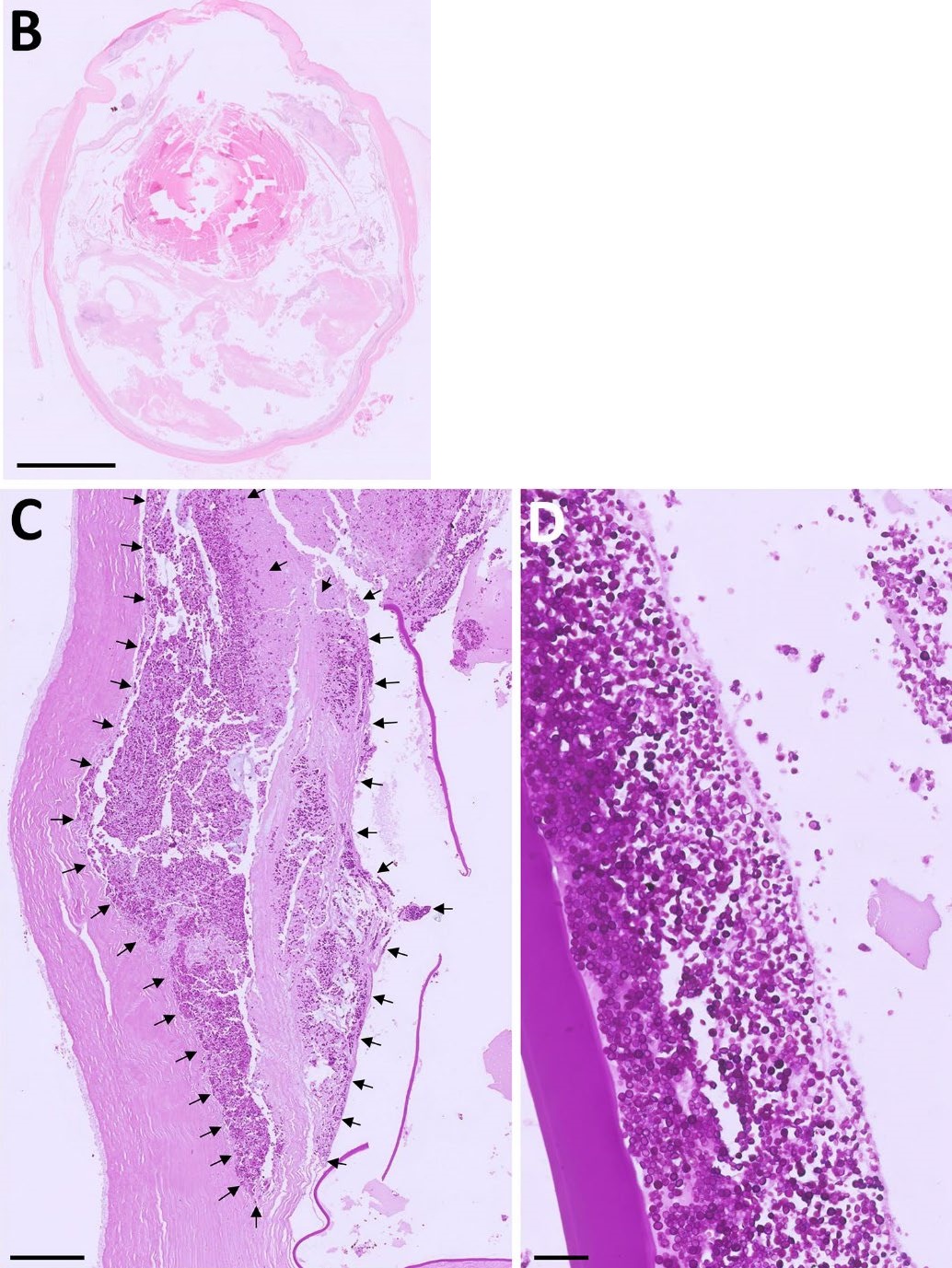
↑ (B) HE染色的全眼切片显示自溶引起的严重伪影,以及充满前后房和后段的嗜酸性渗出物。(C) PAS染色揭示了与先前检测到的大沉积物相对应的多种微生物侵入角膜深基质(黑色箭头)。(D) PAS染色晶状体的放大切片显示存在多种细胞内微生物。
扩增出18S rDNA序列、28S rDNA序列和细胞色素B基因序列的PCR检测中,眼部样本检测出无绿藻阳性。
06 讨论
原藻病(Protothecosis)又名无绿藻病、原壁菌病,是一种由无绿藻(Prototheca spp.)引起的罕见疾病,在人类和动物中均有描述,会出现全身性疾病、皮肤病变或两者兼而有之[1,2]。无绿藻已被确定为猫皮肤病变和1例弥漫性神经系统疾病的原因[2-4]。无绿藻病的诊断可能具有挑战性,通常基于对组织和体液中生物体的观察[5]。需要培养或PCR进行明确诊断和物种鉴定[2,4]。
已有报道称,一只有中枢神经系统症状的猫患有播散性无绿藻感染,疑似诊断为多灶性淋巴瘤;然而,在其他报告中,猫无绿藻病与皮肤或皮下病变有关[2-4]。
在本病例中,这只猫有长期服用糖皮质激素治疗肠道疾病的病史,这可能会引发动物的免疫抑制。此外,这只猫接受了2次粪便移植,这可能是潜在的感染源。
之前的研究表明,伯曼猫对某些传染病高度敏感,包括衣原体、隐球菌、猫传染性腹膜炎和胎儿三毛滴虫感染[6-9]。然而,无法确定感染的主要来源,因为这种藻可以在多种环境中找到。本研究的另一个局限性是,无法在体外分离无绿藻菌株来评估其培养特性。
总之,本病例描述了一种新的微生物物种入侵猫的眼部组织,这是猫中罕见的临床表现。本研究结果还扩展了动物无绿藻遗传多样性的知识,这是一条关于具有人畜共患潜力的病原体的宝贵信息。
文献来源:Jimenez-Ramos L, Ripolles-Garcia A, Lanave G, Pellegrini F, Caro-Suarez M, Latre-Moreno A, Ferruz-Fernandez M, Palmero-Colado ML, Carballes-Perez V, Melendez-Lazo A, Naranjo C, Laguna F, Martella V, Villagrasa M. Endogenous Endophthalmitis Caused by Prototheca Microalga in Birman Cat, Spain. Emerg Infect Dis. 2025 Jan;31(1):189-192.
参考文献
1. Ahrholdt J, Murugaiyan J, Straubinger RK, Jagielski T, Roesler U. Epidemiological analysis of worldwide bovine, canine and human clinical Prototheca isolates by PCR genotyping and MALDI-TOF mass spectrometry proteomic phenotyping. Med Mycol. 2012;50:234–43.
2. Sykes JE. Protothecosis and chlorellosis [chapter 90]. In: Sykes JE, editor. Greene’s infectious diseases of the dog and cat, 5th edition. St. Louis: Elsevier, Inc.; 2023. p. 1126–34.
3. Ely VL, Espindola JP, Barasuol BM, Sangioni LA, Pereira DB, Botton SA. Protothecosis in veterinary medicine: a minireview. Lett Appl Microbiol. 2023;76:ovad066.
4. Lanave G, Pellegrini F, Palermo G, Zini E, Mercuriali E, Zagarella P, et al. Identification of Prototheca from the cerebrospinal fluid of a cat with neurological signs. Vet Sci. 2023;10:681.
5. Webb AA, Cullen CL. Ocular manifestations of systemic disease, part 1: the dog [chapter 37.1]. In: Gelatt KN, editor. Veterinary ophthalmology, 6th edition. Hoboken (NJ): John Wiley & Sons; 2021. p. 2329–420.
6. Wills J, Howard P, Gruffydd‐Jones T, Wathes CM. Prevalence of Chlamydia psittaci in different cat populations in Britain. J Small Anim Pract. 1988;29:327–39.
7. Foley JE, Pedersen NC. The inheritance of susceptibility to feline infectious peritonitis in purebred catteries. Feline Pract. 1996;24:14–22.
8. Golovko L, Lyons LA, Liu H, Sørensen A, Wehnert S, Pedersen NC. Genetic susceptibility to feline infectious peritonitis in Birman cats. Virus Res. 2013;175:58–63.
9. Kuehner KA, Marks SL, Kass PH, Sauter-Louis C, Grahn RA, Barutzki D, et al. Tritrichomonas foetus infection in purebred cats in Germany: prevalence of clinical signs and the role of co-infection with other enteroparasites. J Feline Med Surg. 2011;13:251–8.