
| 品种:混种猫 | |
| 年龄:15岁 | |
| 性别:雌 | |
| 诊断:胆道囊肿 | |
01 主诉及病史
因厌食和呕吐就诊。
02 检查
体重3公斤。心率190 bpm,呼吸频率30次/分,毛细血管再充盈时间3秒,直肠温度38°C,没有观察到其他异常。血液检测,包括全血细胞计数和血生化,未发现明显异常。
腹部超声显示胆囊明显扩张,轮廓规则,壁完整性得以保留,无回声内容物中含有适量悬浮的细小高回声碎片。还发现了一种无定形、强回声、均匀的结构,其轮廓清晰,长度约0.51厘米,显示出轻微的后部声学阴影。在胆囊尾部附近观察到无回声囊状物,提示胆总管扩张、囊肿或肿瘤形成(下图)。小肠所有三个节段的壁都增厚,运动性略有增加,壁层保持不变,提示炎症性肠病。出于诊断目的,需要进行剖腹探查。
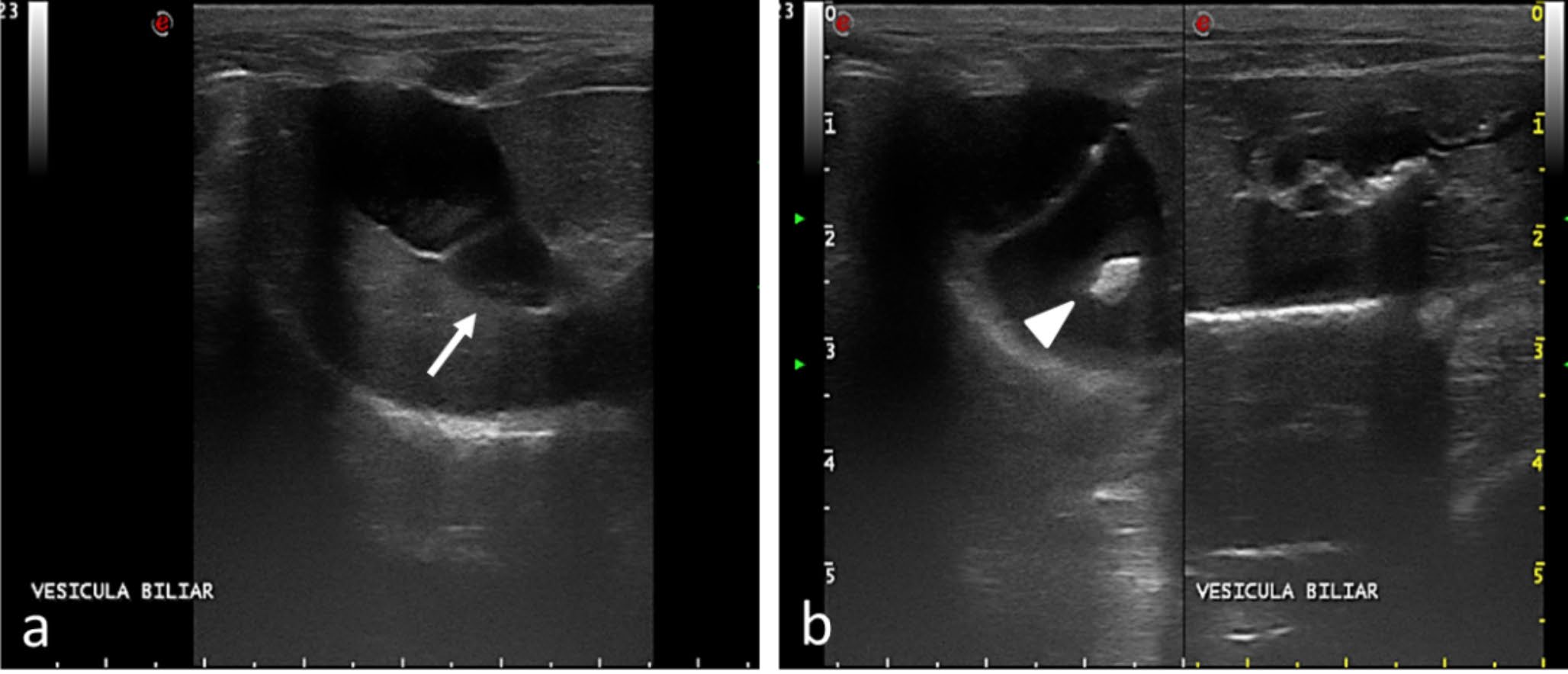
↑(a)胆囊尾部附近有无回声内容物的囊状物(箭头)。(b)胆囊明显扩张,无定形结构(箭头)长0.51厘米。
03 手术
静脉注射芬太尼(2 μg/Kg)、氯胺酮(1.5 mg/Kg)和丙泊酚(4 mg/Kg)进行麻醉诱导。使用3.5 mm气管插管进行经口气管插管,并使用Baraka非再呼吸系统在100%氧气中汽化异氟烷维持麻醉。除吸入麻醉外,持续静脉输注右美托咪啶(0.5 μg/Kg/h)、芬太尼(5 μg/Kg/h)和氯胺酮(1 mg/Kg/h)用于镇痛维持。使用头孢噻吩(30 mg/Kg,IV)进行抗微生物预耐受,并通过硬膜外注射利多卡因(0.18 ml/Kg)、吗啡(0.1 mg/Kg)和布比卡因(0.18 ml/Kg)进行局部阻滞。
通过脐前正中切口进行剖腹术,暴露胆囊后,使用海绵夹仔细解剖胆囊-肝脏交界处的内脏腹膜。用纱布和镊子轻轻牵引和钝性剥离,将胆囊从肝脏中取出。
在胆囊管区域观察到胆囊附近的囊状物,似乎通过一个结构与胰腺相连(下图a)。检查肝、胰和胆总管是否存在可能损害正常胆道功能的结石,但什么也没找到。然后将囊状物从相邻结构中解剖出来,以确定其范围(下图b)。由于它局限于胆囊管的远端,没有完全累及胆总管,因此胆囊管和胆囊动脉被夹在囊状物的正下方,靠近胆总管。使用3-0缝线进行结扎,进行胆囊切除术,并完全切除囊状物(下图c)。使用2−0缝线进行腹壁闭合,使用3−0缝线缝合皮下组织,使用3-0缝线缝合皮肤。由于患者已经厌食数天,因此放置了食管造口管以提供营养支持。
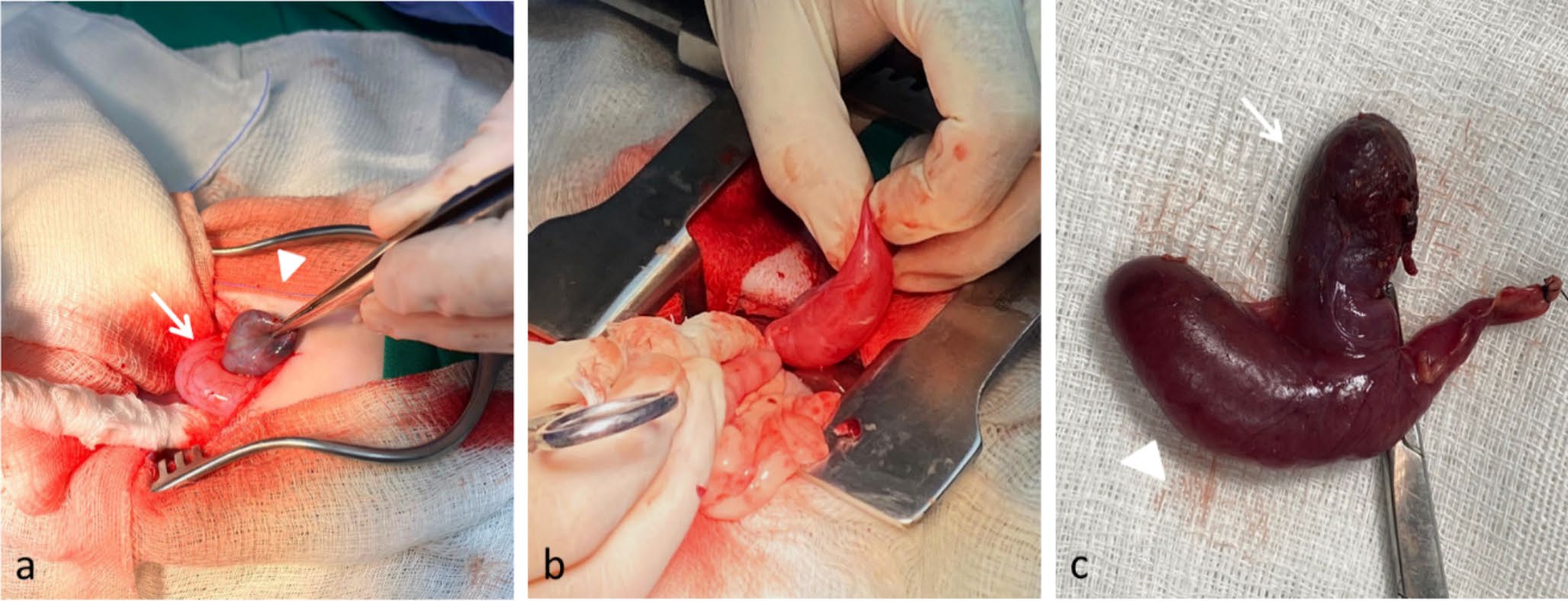
↑(a)胆囊的识别和夹紧(三角),其尾部有一个胆道囊肿(箭头)。(b)从邻近结构中切除胆道囊肿。(c)切除胆囊(箭头)并完全切除胆道囊肿(三角)。
通过细针抽吸收集囊内的液体进行细胞学分析,同时将胆囊和邻近的囊肿送去进行组织病理检查。细胞学分析显示,细胞样本充足,具有嗜碱性背景和粘液特征,提示囊性内容物。
组织病理学显示,胆囊尺寸为3×1 cm,在胆囊管区域的胆管颈附近,观察到一个4.5×1 cm圆柱形结构(下图a)。该结构表面规则,呈灰色。切片后呈管状,充满白色奶油状内容物,并通过隔膜与胆囊分离(下图b)。
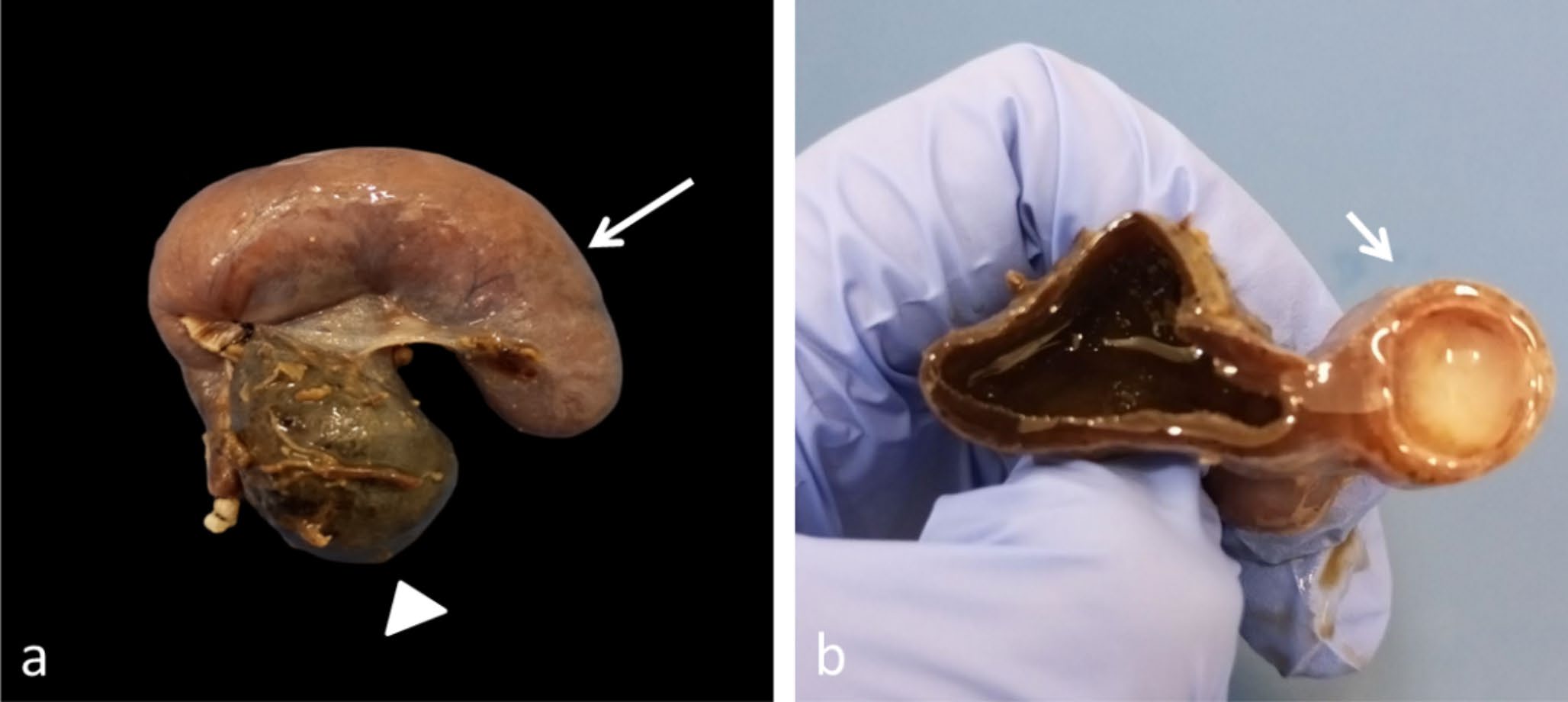
↑(a)胆囊(三角),其圆柱形结构在胆管颈(箭头)附近,尺寸为4.5×1厘米,表面规则,呈灰色。(b)切片后,囊肿结构(箭头)呈管状,充满白色奶油状内容物,并通过隔膜与胆囊隔开。
显微镜下,观察到一个从胆囊浆膜层突出的结构,由一个由成熟纺锤形细胞(可能是成纤维细胞和肌成纤维细胞)、精致的胶原基质、轻度多发性淋巴浆细胞炎症、轻度多灶性出血组成的壁组成,并内衬一个简单的立方上皮(下图)。这些发现与胆总管囊肿的诊断一致。
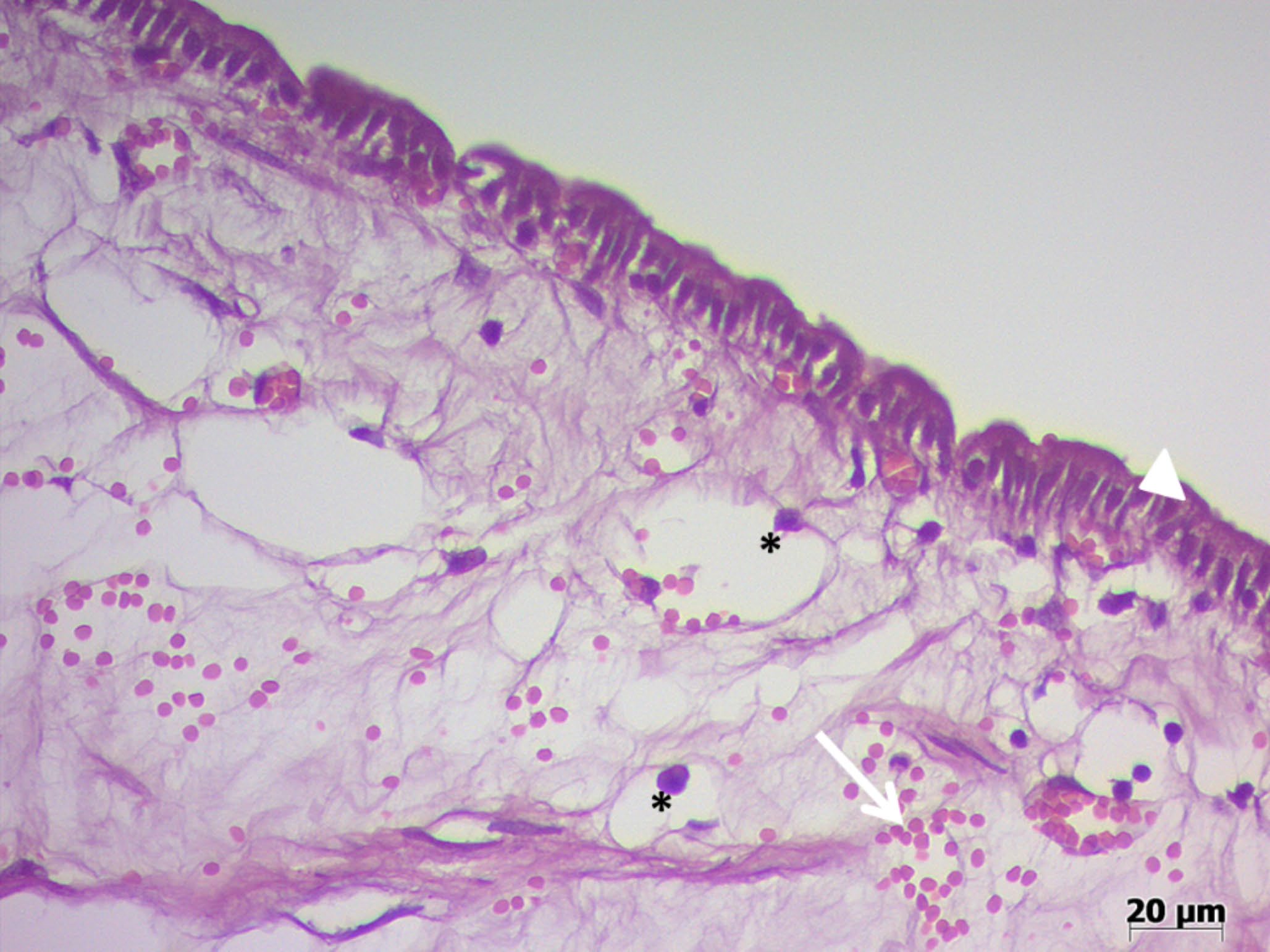
↑ 胆总管囊肿,其壁由成熟的梭形细胞、脆弱的胶原基质、淋巴浆细胞炎症(星号)、出血(箭头)组成,并内衬简单的立方至柱状上皮(三角)。
04 预后
术后开具了以下药物:美洛昔康(0.1 mg/Kg,q24h,IV)、美沙酮(0.3 mg/Kg,q6h,SC)、安乃近(25 mg/Kg,q8h,IV)、头孢噻吩钠(25 mg/Kg,q8h,IV)、甲硝唑(15 mg/Kg,q12h,IV)和奥美拉唑(1 mg/Kg,q12h,IV)。
术后3天,全血细胞计数显示低蛋白血症(5.6 g/dL [6.0-8.0])、白细胞增多(27700个/μL [5500-19500])伴中性粒细胞增多(22714个/μL [2500-12500])、带状中性粒细胞(554个/μL [0-300])和毒性中性粒细胞。生化分析发现低白蛋白血症(17.6 g/L [21-33])。
术后7天,出院后接受以下治疗:奥美拉唑(1 mg/Kg,q12h,PO,7天)、甲硝唑联合磺法地美星混悬剂(25 mg/Kg,q12h,PO,5天)和米氮平(2 mg,q48h,PO,3剂)。
术后14天,皮肤缝线和喂食管被移除。血细胞计数正常。超声显示肝脏具有合适尺寸、规则的轮廓、均匀和正常回声的实质,以及正常口径的血管和胆管。胰腺尺寸保持不变,边缘规则,薄壁组织正常且均匀,胰管正常。讨论了炎症性肠病的治疗选择,建议进行肠道活检。然而,主人选择开始用苯丁酸氮芥和改变饮食进行治疗。
术后12个月,患者临床状况良好。
05 讨论
在人类中,胆总管囊肿,也称为胆道囊肿,是一种罕见的先天性扩张,可影响肝外和肝内胆管。其发展的确切原因尚不清楚,但据信与胆道畸形有关。根本原因是推测性的,包括肝外胆管上皮的胚胎性过度增殖、节段性神经节细胞缺失、胆管粘膜细胞间粘附的干扰以及发育过程中的胰芽融合[1,2]。当这些囊肿发生在成年人身上时,它们通常与肝外导管远端梗阻有关,导致获得性节段性扩张[2]。
猫的肝胆异常中副胆囊最为明显,患病率为12%。然而,兽医文献中很少有关于胆道囊肿的报道。孤立性胆管囊肿和肿瘤(如囊腺瘤)等病变通常是老年猫尸检中的偶然发现[2,3]。这些囊肿在猫身上是零星的,表现出不同的临床进展,通常与胆管炎、胰腺炎和/或并发肠炎等疾病有关[2]。在猫中,对胆管囊肿发展的研究有限,不同的病理机制在这一过程中起着不同的作用。
在人类医学中,胆总管囊肿根据解剖发现和胆道受累程度分为以下几类:I型代表肝外胆管梭形扩张;II型是一个孤立的肝外憩室,表现为胆总管附近的无回声囊肿,胆囊和肝管外观正常;III型涉及胆管十二指肠内部分的扩张;IV型以肝内外胆管联合扩张为特征;V型包括肝内胆管系统的囊性扩张[1,4,5]。
在本病例中,胆道囊肿的诊断是通过手术中的直接可视化做出的,并得到了病理分析的证实。尽管由于这种情况在猫中很少见,兽医学中不存在这种解剖分类[2,6],但根据人类的分类系统,本病例的囊肿可以归类为II型。然而,其起源尚未确定。
猫的胆道系统孤立性肝外囊肿并不常见。一般来说,大多数囊性疾病是多灶性的,与多囊性疾病有关,影响肾脏或肝脏[3,7]。在这种情况下,厚壁囊肿位于胆囊远端,但与胆囊管相连。该囊肿与胆总管和胆囊管有关。胆总管到十二指肠乳头直径正常,没有扩张或梗阻的迹象,肝管和胰管的情况也是如此。
没有胆道梗阻的动物的临床症状是非特异性的,可能包括呕吐、厌食、嗜睡、多尿、多饮和右上腹部疼痛[8]。鉴于这些临床症状的广泛性,超声检查在补充临床评估方面变得至关重要。
在人类中,人们认为大多数胆道囊肿病例都是先天性的,然而,约20%是在成年人中诊断出来的[3]。已经提出了各种理论来解释囊肿的晚期发展,包括胆总管壁的潜在脆弱性,有或没有远端梗阻,以及胰胆管连接异常。这种异常导致了一个细长的公共通道,有助于胰胆管反流,导致胆道和胰腺的各种病理状况,包括炎症和最终扩张[1,7]。
根据兽医学推断,这一理论似乎是合理的,因为猫的胃肠道解剖结构包括一个相对较短的小肠,胰管在十二指肠乳头处进入十二指肠之前与胆总管相连。这些解剖适应增加了胰胆管反流的风险[2]。囊肿很可能是先天性的,考虑到本患者是一只老年猫,多年来逐渐膨胀可能会导致迟发性临床症状,导致相关的胆管炎和炎症性肠。或不排除囊肿晚期发展与原发性肠道病理有关的可能性。
手术干预,包括完全切除胆道囊肿,是首选的治疗方法,因为它消除了继发并发症的潜在诱因。仔细评估剩余的肝外胆管和胰腺系统对于确认导管通畅和防止未来潜在的梗阻至关重要[4]。
囊性组织的恶性转化导致癌的形成,已被描述为人类患者未经治疗的囊肿的并发症。因此,完全切除囊肿总是首选[3]。在这种情况下,猫的囊肿完全切除降低了肝外胆道复发性炎症的风险,并最大限度地降低了未来并发症(如梗阻和肿瘤)的可能性。然而,鉴于未知的根本原因,长期结果仍不确定,需要持续监测。
虽然手术很成功,患者在术后12个月内完全康复并保持稳定,但重要的是要认识到目前关于猫这种情况的知识差距。依赖从人类医学文献中推断信息到兽医学是一个重大挑战,给类似病例的管理和预后带来了不确定性。尽管这一病例的结果令人鼓舞,但还需要进一步的研究来提高对猫这种疾病的认识,并为诊断和管理这种疾病制定明确的指导方针。
文献来源:Bernicker ET, Pedrotti LF, Molozzi H, Dos Santos AB, Levandowski R, do Nascimento Libardoni R. Surgical approach to a biliary tract cyst in an elderly cat. Vet Res Commun. 2025 Jan 23;49(2):89.
参考文献
[1] Khandelwal C, Anand U, Kumar B, Priyadarshi RN (2012) Diagnosis and management of choledochal cysts. Indian J Surg 74:29–34.
[2] Schreeg ME, Miller SA, Cullen JM (2021) Choledochal cyst with secondary cholangitis, choledochitis, duodenal papillitis, and pancreatitis in a young domestic shorthair cat. J Vet Diagn Invest 33:782–787.
[3] Best EJ, Bush DJ, Dye C (2010) Suspected choledochal cyst in a domestic shorthair cat. J Feline Med Surg 12:814–817.
[4] Bhavsar MS, Vora HB, Giriyappa VH (2012) Choledochal cysts: a review of literature. Saudi J Gastroenterol 18:230–236.
[5] Soares KC, Arnaoutakis DJ, Kamel I, Rastegar N, Anders R, Maithel S, Pawlik TM (2014) Choledochal cysts: presentation, clinical differentiation, and management. J Am Coll Surg 219:1167–1180.
[6] Ronnekleiv-Kelly SM, Soares KC, Ejaz A, Pawlik TM (2016) Management of choledochal cysts. Curr Opin Gastroenterol 32:225–231.
[7] Otte CM, Penning LC, Rothuizen J (2017) Feline biliary tree and gallbladder disease: aetiology, diagnosis and treatment. J Feline Med Surg 19:514–528.
[8] MacPhail C, Fossum TW (2019) Surgery of the extrahepatic biliary system. In: Fossum TW (ed) Small animal surgery, 5th edn. Elsevier, Philadelphia, pp 571–584.