
| 一般情况 | |
|---|---|
 | 品种:藏獒 |
| 年龄:1.5岁 | |
| 性别:未知 | |
| 是否绝育:未知 | |
| 诊断:角膜内皮营养不良 | |
01 主诉及病史
超声乳化术后左眼出现角膜水肿。
02 检查
左眼角膜出现弥漫性水肿(下图),使用高渗盐水或外用非甾体抗炎药后仍不见好转。右眼无异常。角膜中心厚度为1400 μm。荧光素未发现上皮缺损。角膜水肿评估结果为4级(严重水肿)。
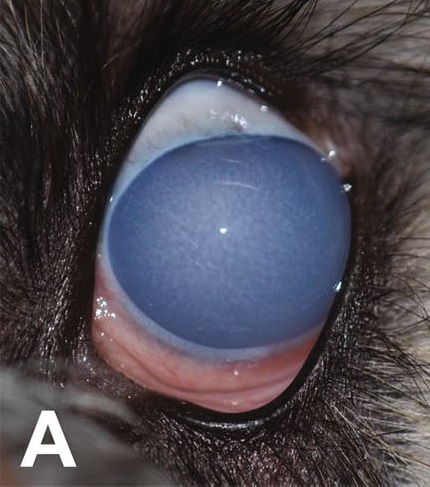
03 移植前准备
由于需要一种既能容纳15 mm大小的移植物,又能在6 mm切口内安装的装置。使用SolidWorks软件设计了装置,并使用医用级聚碳酸酯注塑了该装置。防水帽使用了3D打印。将这一设备称为”Luna Inserter”,下图展示了预装了胰蓝染色移植物的Luna Inserter。

供体组织取自一只两岁大的万能㹴(Airedale)。从死亡到手术时间为一天,角膜储存在Optisol GS中。术前测量的移植物内皮细胞数为3149个/mm2。供体角膜厚度为575 μm,在此基础上用微型角膜切割器切割出150 μm的移植物,再用9.5 mm取样器进一步切割。
由于受体角膜弥漫性水肿,手术视野可能受到限制,因此用胰蓝对供体移植物的角膜基质进行了染色。然后,在23G眼科钳的帮助下,将移植物预装到Luna Inserter前部。盒内注入 Optisol。
04 手术
采用标准手术技术对患者进行定位和预处理。通过1点钟方向的1.1 mm切口进行前房输液。通过第二个11点钟方向的1.1 mm切口,将反向Sinskey钩和Terry刮刀引向前方,剥离并去除中央10 mm的后弹力层。使用5.2 mm角膜刀延长11点钟方向的周边切口,并将其扩大,使Luna Inserter的尖端能够进入前房。
在靠近角膜缘的5点钟位置创建了第三个1.1 mm切口。23G眼科钳通过腹侧1.1 mm切口进入前房,并从11点钟切口伸出。将Luna Inserter翻转过来,使内皮面朝向后方。眼科钳抓住供体移植物的边缘。一旦确认移植物已植入,眼科钳就会引导移植物通过切口进入前房。
用10-0尼龙线间断缝合切口,并在移植物后方放置一个含有20% SF6气体的气泡,将其固定在角膜上。用27G针头和5 cc注射器将气体注入前房,使前房充盈65%。气泡保持20分钟,以促进移植物附着。
20分钟后,从前庭排出少量气体,留下一个7-9 mm气泡,用于术后支撑移植物。该气泡预计将在两天后溶解。使用10-0尼龙线将移植物固定,结膜下注射倍他米松和庆大霉素。
术后每4小时测量一次眼压。局部使用莫西沙星、二氟泼尼特和润滑凝胶,每6小时一次,持续1个月,在3个月内逐渐减少到每天两次,6个月后停用。口服药物包括阿莫西林/克拉维酸12.5 mg/kg,Bid,连续10天;环孢素5 mg/kg,Qd,连续30天;加巴喷丁4 mg/kg,Bid,连续10天。泼尼松龙的剂量从1 mg/kg Bid减至1 mg/kg Qd,持续7天,然后再减至0.5 mg/kg Qd,直至角膜清晰为止。
术后 2-3 周使用伊丽莎白项圈。术后使用UBM评估移植角膜的位置。
05 预后
术后未出现并发症。术中未观察到纤维蛋白积聚,术中和术后也无需注射tPA。
术后第1天,移植物已连接,缝线完好。愈合过程顺利,无角膜溃疡或气体渗漏。
从手术到角膜清晰大约需要1-2周时间。一周后,角膜开始变透明,移植角膜和供体角膜的厚度合计为1410 μm。
4个月后,角膜变得清澈,手术眼的中央角膜厚度为800 μm。
患者术后每6个月复查一次,在术后4年的最后一次复查中,移植眼的角膜仍然清晰。
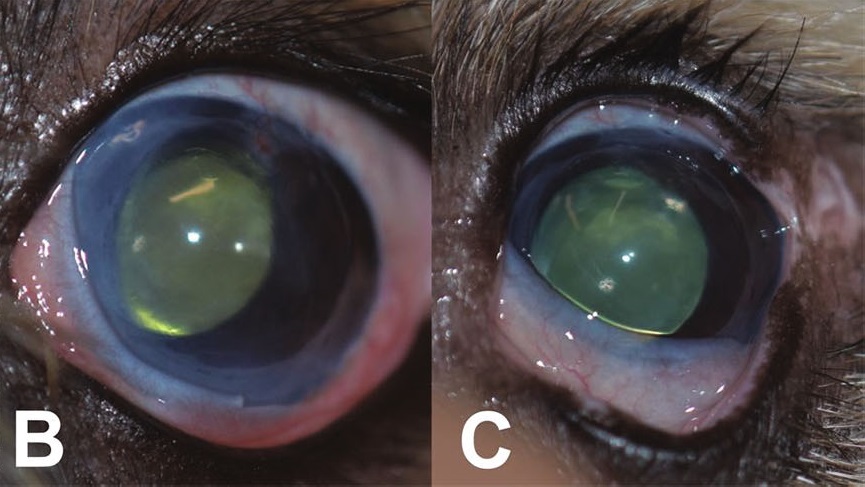
06 讨论
角膜内皮营养不良(Corneal endothelial dystrophy,CED)是一种角膜致残性疾病,其特征是角膜内皮细胞失代偿,形成鼓泡和溃疡性角膜炎。
犬CED的治疗通常包括表层角膜切除术和结膜瓣的使用[1-3]。最近针对犬CED引入了后弹力层剥离角膜内皮移植术(Descemet’s stripping endothelial keratoplasty,DSEK)[4,5],该方法可直接解决潜在的内皮功能衰竭问题,从而延长光学清晰度。该手术需要切除患者的角膜后弹力层,然后用具有活力内皮细胞的后角膜层移植替代。
犬内皮角膜移植术(endothelial keratoplasty,EK)面临的一个挑战是缺乏可容纳或运输较大组织移植体的设备,因为犬的角膜直径通常为15-20 mm,而人类的通常为10-11 mm[3]。保护内皮细胞是成功移植的关键,而将移植组织从角巩膜缘转移到前房可能会导致内皮细胞丢失。为了弥补这一不足,本研究设计了一种专用设备,以方便为患有CED的犬进行EK。
之前关于犬DSEK的报道显示,术后3个月和12个月的疗效良好[2,3],但目前尚不清楚移植物是否能在一年后保持清晰。本病例报道描述了用DSEK治疗犬眼部疾病的情况,证明了术后4年角膜清澈,并公开分享了设计文件,以便进一步复制或迭代。
本研究补充证明了在狗身上进行DSEK的可行性[4,5]。通过角膜厚度测量来确认犬角膜术后的健康状况。角膜清晰度和角膜厚度的减少在一周内就能发现。
犬EK面临着独特的挑战,下表中总结了这些挑战。包括移植物较大、宿主角膜较灵活且可能在手术中塌陷、通过弥漫性水肿角膜的可视范围有限、术后定位能力有限以及犬眼炎症反应强烈等。

本研究使用的装置能够保持移植物的内皮-内构型,有利于移植物在前房中的定位,并减轻外科医生的负担。随着更多装置的开发,未来的研究可能会比较不同植入方法的内皮细胞存活率。
无论是犬还是人类,移植物脱落都是DSEK的潜在并发症。本病例在背侧和腹侧应用了不可吸收的10-0缝线,将移植物固定在邻近的受体基质上,人类身上也应用过这种技术[8]。不过,缝合可能会导致其他并发症,如上皮细胞下垂或局灶性真菌或细菌感染,因此术后应监测和/或拆除缝线。
尽管替代性姑息治疗可有效减轻疼痛和感染,但犬DSEK可作为CED的一线治疗方法,因为它能部分恢复视力。未来的研究可以评估这种方法在恢复视力方面的效果和效率。
参考文献
1. Horikawa T., Thomasy S. M., Stanley A. A., et al. Superficial keratectomy and conjunctival advancement hood flap (SKCAHF) for the management of bullous keratopathy: validation in dogs with spontaneous disease. Cornea. 2016;35(10):1295–1304.
2. Nicole M. Corneal edema in four horses treated with a superficial keratectomy and Gundersen inlay flap. Veterinary Ophthalmology. 2017;20(1):65–72.
3. Giannikaki S., Escanilla N., Sturgess K., Lowe R. C. A modified technique of keratoleptynsis (“letter-box”) for treatment of canine corneal edema associated with endothelial dysfunction. Veterinary Ophthalmology. 2020;23(6):930–942.
4. Armour M. D., Askew T. E., Eghrari A. O. Endothelial keratoplasty for corneal endothelial dystrophy in a dog. Veterinary Ophthalmology. 2019;22(4):545–551.
5. Boo G., Whittaker C. J. G., Caruso K. A., et al. Early postoperative results of Descemet’s stripping endothelial keratoplasty in six dogs with corneal endothelial dystrophy. Veterinary Ophthalmology. 2019;22(6):879–890.
6. Thomasy S. M., Cortes D. E., Hoehn A. L., Calderon A. C., Li J. Y., Murphy C. J. In vivo imaging of corneal endothelial dystrophy in Boston terriers: a spontaneous, canine model for Fuchs’ endothelial corneal dystrophy. Investigative Ophthalmology & Visual Science. 2016;57(9):OCT495–OCT503.
7. Ang M., Saroj L., Htoon H.-M., Kiew S., Mehta J. S., Tan D. Comparison of a donor insertion device to sheets glide in Descemet stripping endothelial keratoplasty: 3-year outcomes. American Journal of Ophthalmology. 2014;157(6):1163–1169.e3.
8. Li G., Shekhawat N. S., Eghrari A. O. Sutured Descemet membrane endothelial keratoplasty in patients with complex anatomy or difficulty positioning. Cornea. 2023;42(3):389–394.
9. Chamberlain W., Lin C. C., Austin A., et al. Descemet endothelial thickness comparison trial: a randomized trial comparing ultrathin Descemet stripping automated endothelial keratoplasty with Descemet membrane endothelial keratoplasty. Ophthalmology. 2019;126(1):19–26.